Autores: María Teresa Alarcón Alacio1, Cristina Aparicio López2, Carmen de Lucas Collantes2, Víctor Manuel García Nieto3.
1 Servicio de Pediatría. Hospital Universitario de Fuenlabrada, Madrid
2 Servicio de Pediatría. Hospital Universitario Niño Jesús. Madrid
3 Servicio de Pediatría. Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife
Raquitismo en el siglo XXI: del raquitismo carencial a los anticuerpos monoclonales
Resumen
El raquitismo carencial es, en las últimas décadas, una rareza en niños nacidos en nuestro país, consecuencia de la profilaxis sistemática con vitamina D que reciben los lactantes durante el primer año de vida. Sin embargo, el diagnóstico de otras formas de raquitismos, como es el raquitismo hipofosfatémico familiar, también llamado hipofosfatemia ligada al cromosoma X (XLH del inglés X-linked hypophosphatemia), está en auge. El mejor reconocimiento de la enfermedad y una mayor accesibilidad a los estudios genéticos, pueden ser la causa del aumento en el diagnóstico de la misma, dado que sus manifestaciones clínicas pueden oscilar desde el raquitismo florido hasta la hipofosfatemia aislada. Presentamos una revisión de los tratamientos empleados en esta enfermedad, desde las primeras descripciones del raquitismo carencial, pasando por el raquitismo vitamina D resistente, hasta la descripción de raquitismo hipofosfatémico familiar y la aparición de las primeras publicaciones científicas al respecto
Palabras clave:
burosumab, raquitismo, vitamina D
Rickets in the XXI century: from deficiency rickets to biologic drugs
Abstract
In recent decades, deficiency rickets has been an inusual disease in children born in our country, as a result of the systematic vitamin D prophylaxis received by infants during the first year of life. However, the diagnosis of other forms of rickets, such as familial hypophosphatemic rickets, also called X-linked hypophosphatemia, is raising. Better recognition of the disease and greater accessibility to genetic studies might be the cause of the increase in its diagnosis, since its clinical manifestations can range from severe rickets to isolated hypophosphatemia. We present a review of the treatments used in this disease, from the first descriptions of deficiency rickets, through vitamin D-resistant rickets, to the description of familial hypophosphatemic rickets and the appearance of the first scientific publications on the subject.
Keywords:
burosumab, rickets, vitamin D
Introducción. Raquitismo carencial
Fue en el siglo XVII cuando encontramos las primeras descripciones clínicas de raquitismo por parte de Whistler, Boote, Glisson y Mayow1,2. Es en esta época cuando se identificó el raquitismo como un problema de salud importante entre los niños pequeños, coincidiendo con las modificaciones en el estilo de vida secundarias a la revolución industrial2. El papel protector de la exposición solar sobre el desarrollo del raquitismo, fue documentado por primera vez en 1822 por Sniadecki, que observó que los niños que vivían en Varsovia tenían una incidencia mucho mayor de la enfermedad en comparación con la de los niños que vivían en áreas rurales, concluyendo que la exposición a la luz solar era el factor fundamental en la prevención y cura del raquitismo2. Por otra parte, el papel de la dieta en el desarrollo de raquitismo fue comunicado por primera vez por el doctor inglés Edward Mellanby en 1919, demostrando en un estudio publicado en la revista Lancet3, la posibilidad de inducir raquitismo en perros al privarles de la luz solar y alimentarles a base de copos de avena, así como la resolución del mismo al administrarles aceite de hígado de bacalao (figura 1). El autor concluyó, por tanto, que el origen del raquitismo era de índole dietética3.

Figura 1. Radiografía de la muñeca de un cachorro normal y tras tres meses de dieta “raquitogénica”. La flecha indica las epífisis en copa y el ensanchamiento y desflecamiento metafisario típicos del raquitismo3
Inicialmente, se creía que la actividad antirraquítica del aceite de hígado de bacalao podía deberse al efecto de la vitamina A. Sin embargo, la vitamina A se degrada por el calor, y el aceite de hígado de bacalao continuaba conservando su actividad antirraquítica tras exponerlo al mismo. Por todo esto, se concluyó que existía una nueva vitamina liposoluble a la que se llamó vitamina D, puesto que ya se habían descubierto las denominadas A, B y C2. Es así como se descubrió la vitamina D en 19224, base del tratamiento del raquitismo carencial.
Raquitismo vitamina D resistente
Tras el descubrimiento de la vitamina D y el comienzo de su uso masivo como tratamiento antirraquítico, comienzan a surgir publicaciones médicas sobre formas de raquitismo resistentes a este tratamiento. Aunque la primera definición inequívoca de raquitismo vitamina D resistente fue realizada por Albright en 1937 5, existen publicaciones previas que hacen referencia a agregaciones familiares de pacientes con raquitismo resistente a la vitamina D, como la de Baage en 1924 que describía una familia en la que la madre y sus seis hijos, así como al menos tres de sus doce hermanos, padecían una forma de raquitismo desde la infancia, resistente al tratamiento habitual6. Sin embargo, el artículo de Albright, Butler y Bloomberg5 representa la primera descripción exhaustiva de la enfermedad, claramente separada de otras formas de raquitismos tardíos resistentes a vitamina D, como los secundarios a malabsorción, hepatopatía o nefropatía.
Durante algunos años, las publicaciones científicas de la época, parecían confundir las diferentes formas de raquitismo vitamina D resistentes. Es en la publicación de Winters6 ,en 1958, donde se describe por primera vez de forma inequívoca el raquitismo hipofosfatémico familiar. Se trata de una familia con hipofosfatemia, con mayor severidad clínica en varones, y sin trasmisión varón-varón y en las que todas las hijas de varones hipofosfatémicos presentaban hipofosfatemia, sugiriendo una transmisión dominante ligada a X. Además, Winters describe como las personas afectas, tienen una reducción en la TmP/GRF aproximadamente del 50 %, confirmando el aumento de la fosfaturia típico de la enfermedad.
El tratamiento clásico se introdujo por primera vez en 1972 por Glorieux et al.7 al objetivar que el raquitismo de los pacientes con raquitismo hipofosfatémico ligado a X era resistente a la vitamina D2, pero no al tratamiento combinado con vitamina D2 y sales de fosfato inorgánico. Este tratamiento fue modificado por Harrel8 en 1985 sustituyendo la vitamina D2 por calcitriol a dosis suprafisiológicas y ha sido el único tratamiento disponible para la enfermedad hasta 2018.
Fisiopatología del raquitismo hipofosfatémico ligado a X (XLH)
Aunque la patogénesis del XLH no es, a día de hoy, completamente conocida, sabemos que en su origen está implicada la mutación en el gen PHEX 9, que se transmite de forma dominante ligada a X, aunque en muchas ocasiones se trata de mutaciones de novo. Estas mutaciones en el gen PHEX, dan lugar al aumento en la producción por el osteocito de una hormona fosfatúrica, llamada FGF23 (del inglés: ”fibroblast growth factor 23”)10. Sigue siendo desconocido el mecanismo fisiopatológico por el que la pérdida de función de PHEX produce este aumento de FGF23. PHEX forma parte de la familia de genes que controlan la síntesis de endopeptidasas. Experimentos realizados en el hueso del ratón Hyp indican que el aumento de síntesis de FGF23 ocurre por activación de enzimas del grupo proteína quinasa C y estimulación de la vía MAP quinasas, y no por disminución de su degradación como se pensaba11, abriendo nuevas líneas de investigación para encontrar otros tratamientos de la enfermedad.
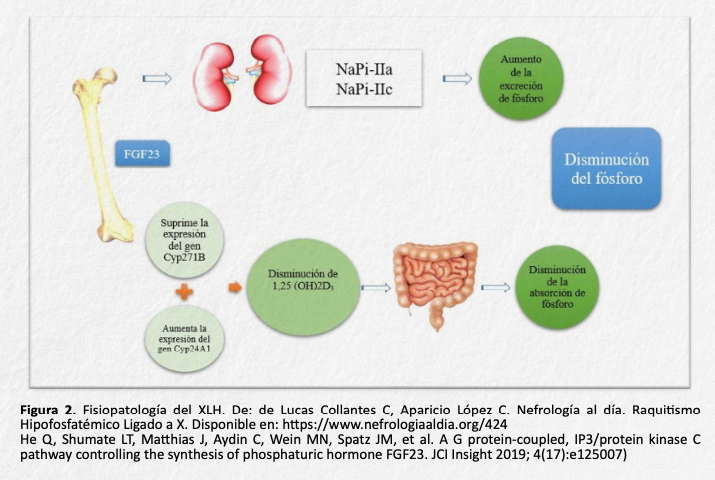
FGF23 actúa uniéndose a sus receptores y al correceptor Klotho, que se encuentran en la membrana basal de las células del túbulo proximal. Así, FGF23 induce una disminución de la expresión de uno de los principales transportadores de fósforo, NaPi tipo II, encargado de reabsorber fosfato en el túbulo proximal. Por tanto, el aumento de FGF- 23, provoca una disminución en la reabsorción de fósforo y un aumento de la fosfaturia (figura 2)10.
Por otra parte, FGF23 inhibe la transcripción del CYP27B1 (que codifica la enzima 1-hidroxilasa de la vitamina D) y aumenta la transcripción de CYP24A1 (que codifica la enzima 24-hidroxilasa). Esta combinación de alteraciones da lugar a la disminución del metabolito activo de la vitamina D, la 1,25- dihidroxivitamina D, cuya función es absorber fosfato a nivel intestinal y óseo, contribuyendo así a la hipofosfatemia. FGF23 también actúa a nivel paratiroideo, donde es capaz de inhibir la producción de PTH, uniéndose de nuevo a su receptor y al correceptor Klotho, mediante la vía de las MAP quinasas10.
Además del exceso de FGF23, se cree que los pacientes con XLH puedan tener un daño de la placa de crecimiento, ya que en ratones Hyp se han demostrado alteraciones estructurales significativas de la misma12. Esta alteración de la placa de crecimiento puede ser fundamental para comprender la afectación del crecimiento que tienen estos pacientes.
Manifestaciones clínicas del XLH
Raquitismo. Deformidades óseas
Los recién nacidos afectos de XLH no presentan datos de raquitismo al nacimiento a pesar de presentar ya en muchos casos pérdida renal de fósforo e hipofosfatemia, como se describe en diferentes publicaciones13. En otros casos, la hipofosfatemia puede aparecer más tardíamente, en torno a los seis meses. Los niveles de fosfatasa alcalina al nacer son normales, aumentando progresivamente en los primeros meses de la vida13. Estos hallazgos son la manifestación de una mineralización ósea inadecuada. En las formas clínicas más graves pueden hallarse alteraciones óseas típicas del raquitismo desde antes de la deambulación, como el retraso en el cierre de la fontanela, ensanchamiento de las metáfisis de muñecas y/o tobillos y rosario costal. Las alteraciones más características surgen con el inicio de la deambulación, momento en el que aparece el arqueamiento del fémur y de la tibia que se traduce en genu varum o menos frecuente en genu valgum. Otra deformidad ósea que pueden presentarse es la coxa vara10.
Creemos importante destacar que una de las principales causas del retraso en el diagnóstico en los pacientes con mutaciones de novo (sin antecedentes familiares), es considerar como “normal” el genu varo que presentan estos pacientes. Los niños hasta los 18 meses pueden presentar genu varo fisiológico, pero existen determinados signos de alarma ante un genu varo como que perdure más de 24 meses, que sea asimétrico, asocie torsión tibial y/o que asocie dolor con la marcha.
A nivel craneal, la afectación más frecuente es la existencia de una frente abombada y en ocasiones, dolicocefalia secundaria a craneosinostosis de una o más suturas; el aplanamiento de la base craneal ocasiona una disminución de la profundidad de la fosa posterior que predispone a malformaciones tipo Chiari I. Estas malformaciones pueden originar dolor de cabeza, vértigo e hipertensión intracraneal10.
La osteoesclerosis y deformación o engrosamiento del hueso petroso, puede conllevar hipoacusia neurosensorial y de transmisión, con una prevalencia variable. Suele presentarse en adultos, aunque puede estar presente desde la adolescencia10.
Talla baja. Afectación del crecimiento
La talla baja, junto con el raquitismo, es uno de los síntomas de presentación que más frecuentemente conduce al diagnóstico de esta enfermedad. A pesar de su relevancia, su mecanismo de producción en el XLH no es del todo conocido14. Se trata de un hipocrecimiento disarmónico, que afecta más al segmento corporal inferior15 y que no se explica únicamente por la pérdida de talla secundaria a la curvatura de las extremidades inferiores. Los pacientes nacen con un longitud normal y se va desviando de la normalidad durante los dos primeros años de la vida. La influencia de esta pérdida de talla sobre la talla adulta, se ha puesto de manifiesto en algunos estudios: los pacientes con diagnóstico e inicio de tratamiento antes de los 12 meses, presentaron menor pérdida de talla que los pacientes tratados posteriormente16.
La alteración del crecimiento de los pacientes con XLH ocurre tanto en pacientes no tratados como en aquellos tratados de forma tradicional, con suplementos orales de fosfato y derivados de vitamina D15,17, lo que ha suscitado la necesidad de profundizar en la fisiopatología del hipocrecimiento en estos pacientes12,14, así como en la búsqueda de diferentes estrategias terapéuticas.
Otras manifestaciones clínicas
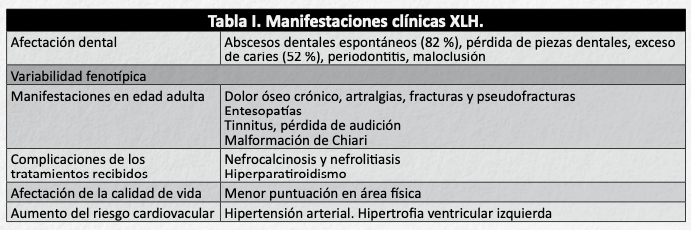
Otras manifestaciones clínicas de la enfermedad se resumen en la tabla I 10.
Hallazgos bioquímicos
Los hallazgos característicos de XLH van a ser la hipofosfatemia, hiperfosfaturia (con disminución de la reabsorción tubular de fosfato (RTP) y de la tasa máxima de reabsorción de fosfato (TmP/GFR), el aumento de fosfatasa alcalina, y las concentraciones bajas o inadecuadamente normales de 1,25 OH vitamina D. La fosfatasa alcalina no suele estar tan elevada como en el raquitismo carencial o en raquitismo por mutación en el receptor de vitamina D18. Es importante destacar también que en situaciones de deplección importante de fosfato, los valores de RTP pueden encontrarse dentro de los valores considerados “normales” en las referencias de los laboratorios. En situación de hipofosfatemia, la RTP debería elevarse por encima del límite superior de la normalidad, y en caso de no producirse esta elevación, la reabsorción renal no es adecuada, teniendo más valor en estos casos la TmP/GFR10.
Los valores de PTH suelen estar normales o mínimamente elevados (menos del 10 % presentan hiperparatiroidismo significativo), a diferencia de otras formas de raquitismo, reflejo de la inhibición que ejerce sobre la producción de la paratohormona el FGF23. La calcemia es normal o está mínimamente descendida, y la calciuria es normal. Las concentraciones de FGF23 se encuentran elevadas o anormalmente normales (en situación de hipofosfatemia, debería estar bajas)10.
La hipofosfatemia en familiares afectos suele encontrarse desde los primeros meses, si bien una concentración de fosfato normal en los primeros meses de vida no excluye el diagnóstico de XLH18. Las guías recomiendan realizar una bioquímica sanguínea con perfil fosfo-cálcico a familiares a partir de la primera semana de vida y en caso de ser normal, repetir en unos meses19.
Diagnóstico: Diagnóstico diferencial de los raquitismos hipofosfatémicos y XLH
El signo guía más frecuente en los pacientes pediátricos sin historia familiar de la enfermedad es el arqueamiento de miembros inferiores, generalmente en varo (aunque también en valgo) y la talla baja. El varo de miembros inferiores es característicamente asimétrico, y pueden presentar dolor sobre todo con la deambulación. En adultos, el signo guía suele ser el dolor óseo crónico.
Ante un paciente con las características clínicas y bioquímicas descritas aneriormente, el estudio de FGF23 (elevado o inadecuadamente normal) y de 1,25 OH vitamina D (baja o inadecuadamente normal), nos puede ayudar en el diagnóstico diferencial con otras formas de raquitismo. Se suele completar el estudio con la solicitud del estudio del gen PHEX, que nos dará el diagnóstico definitivo. Posteriormente, deberemos estudiar a los familiares de primer grado para descartar la presencia de formas oligosintomáticas en la familia, si bien las mutaciones de novo son frecuentes10.
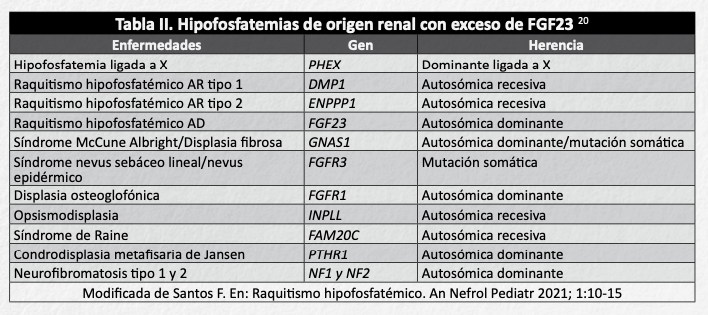
Existen formas mucho más infrecuentes de raquitismo hipofosfatémico mediado por FGF23 (tabla II)20, cuyas características bioquímicas pueden ser similares, si bien difieren en el tipo de herencia y de mutación genética, así como en las manifestaciones clínicas. Es de destacar la forma de raquitismo hipofosfatémico que aparece en el síndrome de McCune Albright/displasia fibrosa, con publicaciones recientes que abalan el empleo de burosumab (anti FGF23) en su tratamiento21.
Tratamiento médico del XLH
Fue en 1972, cuando Glorieux et al.7 describieron el primer tratamiento de la enfermedad, basado en la administración crónica de sales de fósforo (1- 4 gr de fosfato inorgánico al día) y suplementos de vitamina D (vitamina D2 10.000-50.000 UI/día). Posteriormente, en 1985, Harrel et al 8 consigue la curación completa de las lesiones óseas administrando dosis suprafisiológicas de calcitriol en combinación con fosfato oral (1-2 gr al día), reduciendo la dosis del calcitriol tras mejorar las lesiones óseas, manteniéndose la respuesta. Estas son las dos publicaciones en las que se ha basado el tratamiento de la enfermedad durante varias décadas.
El objetivo de este tratamiento es curar las lesiones activas de raquitismo, las deformidades óseas y optimizar el crecimiento. Para ello se recomienda mantener el fósforo sérico en el límite bajo de la normalidad para la edad del paciente o incluso menor, el objetivo no es normalizar la fosforemia, lo cual implicaría un aumento significativo de los efectos secundarios, como son el hiperparatiroidismo secundario y la nefrocalcinosis22.
Sales de fosfato
La dosis inicial más empleada (dosis de fósforo elemento) es 20-40 mg/kg/día en función de la gravedad del fenotipo, con incrementos cada cuatro semanas. Se recomienda no superar los 60-70 mg/kg/día con un máximo en niños mayores de 2-3 gr al día. Dosis superiores a 70 mg/kg/día o 3 gr/1,73m2/día tienen mayor riesgo de producir nefrocalcinosis22. No existe dosis óptima, y dependerá de la respuesta al tratamiento y de la gravedad el fenotipo.
Es importante que el fósforo se administre repartido en varias tomas diarias, idealmente en cinco o seis tomas, ya que tras su ingesta la concentración sérica aumenta rápidamente pero vuelve a su basal en 1,5 horas. Dada la dificultad de realizar un adecuado cumplimiento terapeútico con estas pautas, algunos autores recomiendan disminuir el número de tomas a 3-4 veces al día, cuando se alcance la normalización de los parámetros bioquímicos y en los adolescentes. En cualquier caso, se debe insistir en el intervalo regular de las dosis. El principal efecto secundario del fosfato es la diarrea (que suele autolimitarse), la posibilidad de inducir hiperparatiroidismo (menos probable si se administra en múltiples dosis y asociando vitamina D activa) y el aumento del riesgo de nefrocalcinosis. Además, el fosfato no debe administrarse junto con suplementos de calcio o alimentos con alto contenido de calcio, como la leche, ya que la precipitación en el tracto intestinal reduce la absorción del mismo10,22,23.
Vitamina D activa
Se debe añadir al tratamiento con sales de fosfato, suplementos de vitamina D activa. En nuestro país, se administra en forma de calcitriol o alfacalcidiol. El objetivo es tratar la deficiencia de calcitriol y prevenir el hiperparatiroidismo secundario, además de aumentar la absorción de fósforo a nivel intestinal. Las dosis iniciales empleadas son 20-30 ng/kg/día de calcitriol (Rocaltrol® cápsulas oleosas de 250 o 500 ng), repartidas en 1 o 2 dosis al día, hasta alcanzar un máximo de 50-70 ng/kg/día. En el caso de alfacalcidiol (Etalpha® gotas 1 gota = 0,1 µg), la dosis oscila entre 30 y 50 ng/kg/día y se administra una sola vez al día dada su mayor vida media. Una vez resueltas las lesiones óseas iniciales la dosis de calcitriol podría disminuirse22,23.
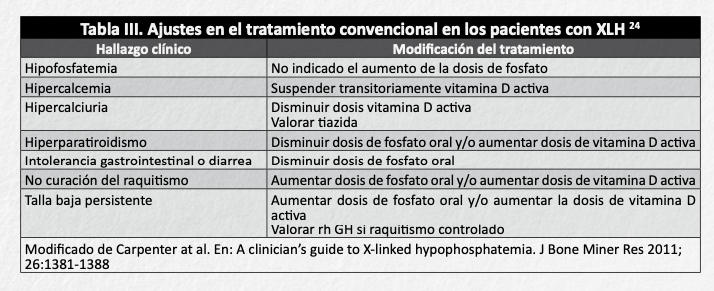
El ajuste de dosis de medicación en el tratamiento convencional se muestra en la tabla III 24.
Hidroclorotiazida
EWn el caso de que aparezca hipercalciuria, puede valorarse la administración de hidroclorotiazida y/o citrato potásico para prevenir la precipitación del calcio especialmente en pacientes con hipocitraturia22. La adición de hidroclorotiazida ha demostrado disminuir la calciuria y evitar la progresión de la nefrocalcinosis en los pacientes con XLH25. En cuanto al citrato potásico, hay que usarlo con precaución, ya que la alcalinización de la orina puede provocar precipitación del fosfato y empeorar la nefrocalcinosis10.
Cinecalcept
El hiperparatiroidismo secundario es un efecto frecuente del tratamiento convencional del XLH. El objetivo es mantener niveles de PTH en rango de normalidad, y en caso de que aparezcan desviaciones, realizar los ajustes oportunos (tabla III). En caso de hiperaratiroidismo persistente a pesar de estas medidas, se han empleado calcimiméticos como cinecalcept, que disminuye los nieveles de PTH y FGF23 y aumenta la TmP/GFR22,26. Su uso debe ser cuidadosamente monitorizado, ya que no está autorizado para esta indicación y se han comuniucado efectos secundarios graves, como hipocalcemia y prolongación del QT 27.
Hormona de crecimiento (GH)
El uso de hormona de crecimiento en pacientes con XLH se ha utilizado en aquellos con hipocrecimiento que persiste a pesar del tratamiento convencional, aunque se sabe que estos pacientes no presentan déficit de la misma. Además, la GH es capaz de aumentar discretamente el fosfato sérico, aumentando la síntesis de 1,25 hidroxivitamina D28. Su uso se ha recomendado con cautela, dada la preocupación de que la aceleración de la velocidad de crecimiento pudiera acentuar la desproporción corporal. Se ha demostrado su efecto sobre la aceleración de la velocidad de crecimiento en niños con XLH que tenían una talla por debajo de -2 DE de los valores de referencia, a pesar de recibir derivados de vitamina D y fosfato, sin agravar la disarmonía29. Sin embargo, el mismo grupo investigador no pudo demostrar estadísticamente efectos beneficiosos del tratamiento con GH sobre la talla adulta final30. Las guías recogen su uso en pacientes con XLH con talla baja, en los que el raquitismo se encuentre controlado en los últimos 12 meses22,23.
Burosumab
En XLH, existe una importante variabilidad fenotípica y en la respuesta al tratamiento denominado “convencional”, de tal modo que una parte no despreciable de los pacientes no responde de modo adecuado a la medicación, persistiendo el raquitismo, las deformidades esqueléticas y la talla baja19. Para dar respuesta a estos pacientes, se inician ensayos clínicos con un nuevo fármaco, un anticuerpo monoclonal humano contra el FGF23, denomidado burosumab31. Las primeras publicaciones científicas de estos ensayos aparecen en 2014, y en el 2018 se inicia su administración fuera de ensayos clínicos32.
Inicialmente fue autorizado en Europa para niños mayores de 1 año y adolescentes en crecimiento, recientemente se ha autorizado también su uso en adultos. Burosumab contrarresta los efectos del FGF23, aumentando la reabsorción de fosfato por el túbulo proximal renal y la 1,25(OH)2 vitamina D. La dosis de inicio en niños y adolescentes de 1 a 17 años es de 0,8 mg/kg de peso redondeando a la decena más cercana, administrado por vía subcutánea cada dos semanas, con dosis máxima de 2 mg/kg/dosis (máximo 90 mg). La dosis debe ajustarse en función del fósforo plasmático tratando de mantener éste en el límite inferior de la normalidad para la edad del paciente. Los incrementos de dosis no deben realizarse en intervalos inferiores a cuatro semanas y las indicaciones para realizar estos incrementos son: niveles de fosfato sérico por debajo del límite inferior de la normalidad y elevación de FA. Se realizarán aumentos de 0,4 mg/kg de peso. Burosumab no debe administrarse junto con fosfato oral ni metabolitos activos de la vitamina D, por lo que el tratamiento convencional debe suspenderse al menos una semana antes de iniciar el tratamiento con burosumab. En caso de coexistir déficit de vitamina D, se podrá administrar suplementos orales de dicha vitamina, hasta alcanzar niveles adecuados de la misma32.
Burosumab ha demostrado ser un fármaco efectivo: incrementa las concentraciones plasmáticas de fósforo y de calcitriol desde las primeras dosis del fármaco, desciende la fosfatasa alcalina, mejora el raquitismo tras 40-64 semanas de tratamiento, la talla baja y la función física32.
Burosumab también ha demostrado ser superior al tratamiento convencional en mejorar el raquitismo, el crecimiento y las alteraciones analíticas que presentan los pacientes con XLH32. Es un fármaco bien tolerado, con efectos secundarios leves, siendo los más frecuentes las reacciones locales en el lugar de la inyección, el dolor de cabeza y de extremidades18.
Al ser un fármaco nuevo, su eficacia a largo plazo y su farmacovigilancia deben llevarse a cabo mediante registros nacionales e internacionales, estando en España incluido actualmente en el sistema Valtermed del Ministerio de Sanidad.
Conclusiones
El desarrollo en las últimas décadas de nuevos fármacos dirigidos frente a dianas terapéuticas concretas ha revolucionado el tratamiento y evolución de muchas enfermedades. Los anticuerpos monoclonales son una opción terapéutica que se introdujo a mediados de la década de los setenta y principios de los ochenta. Debido a que los anticuerpos monoclonales utilizan blancos o targets celulares específicos, muchos de ellos se encuentran entre los fármacos más prometedores en desarrollo, al ser fármacos con una alta eficacia y con una importante reducción de efectos secundarios frente a los tratamientos convencionales. Es el caso de burosumab, anticuerpo monoclonal humano contra el FGF23, medicamento que ha revolucionado el tratamiento y la evolución de los pacientes con una forma genética de raquitismo, como es XLH. La actualización médica continua es necesaria para poder ofrecer a nuestros pacientes las mejores opciones terepéuticas, así como adquirir conocimentos y aptitudes que nos capaciten para diagnosticar precozmente a estos pacientes, garantizando así una evolución óptima de su enfermedad.
Bibliografía
1. O’Riordan JL. Rickets in the 17th century. J Bone Miner Res. 2006; 21:1506-1510
2. Garcia Nieto VM, Zafra Anta M. Enfermedades pediátricas que han pasado a la historia (5). Tetania, espasmofilia y raquitismo carencial. Pediatr Integral 2021; 25:388.e1–388.e7
3. Mellanby E. Nutrition Classics. The Lancet 1:407-12, 1919. An experimental investigation of rickets. Edward Mellanby. Nutr Rev 1976; 34:338-340
4. McCollum EV, Pitz W, Simmonds N, Becker JE, Shipley PG, Bunting RW. The effect of additions of fluorine to the diet of the rat on the quality of the teeth. 1925. Studies on experimental rickets. XXI. An experimental demonstration of the existence of a vitamin which promotes calcium deposition. 1922. The effect of additions of fluorine to the diet of the rat on the quality of the teeth. 1925. J Biol Chem 2002; 277:E8
5. Albright F, Butler A, Bloomberg E. Rickets resistant to vitamine D therapy. Am J Dis Chid 1937; 54:529-547
6. Winters, R. W., Graham, J. B., Williams, T. F., McFalls, V. W., Burnett, C. H. A genetic study of familial hypophosphatemia and vitamin D-resistant rickets with a review of the literature. Medicine (Baltimore)1858; 37:97-142
7. Glorieux, F. H., Scriver, C. R., Reade, T. M., Goldman, H., Rosenborough, A. Use of phosphate and vitamin D to prevent dwarfism and rickets in X-linked hypophosphatemia. New Eng J Med 1972; 287:481-487
8. Harrell RM, Lyles KW, Harrelson JM, Friedman NE, and Drezner MK. Healing of Bone Disease in X-linked hypophosphatemic rickets/osteomalacia induction and maintenance with phosphorus and calcitriol. J Clin Invest 1985; 75:1858-1868
9. A gene (PEX) with homologies to endopeptidases is mutated in patients with X-linked hypophosphatemic rickets. The HYP Consortium. Nat Genet 1995; 11:130-136
10. De Lucas Collantes C, Aparicio López C. Nefrología al día. Raquitismo hipofosfatémico ligado a X. Disponible en: https://www.nefrologiaaldia.org/424
11. He Q, Shumate LT, Matthias J, Aydin C, Wein MN, Spatz JM et al. A G protein-coupled, IP3/protein kinase C pathway controlling the synthesis of phosphaturic hormone FGF23. JCI Insight 2019; 4:e125007
12. Fuente R, Gil-Peña H, Claramunt-Taberner D, Hernández-Frías O, Fernández-Iglesias Á, Hermida-Prado F, et al. Marked alterations in the structure, dynamics and maturation of growth plate likely explain growth retardation and bone deformities of young Hyp mice. Bone 2018;116:187-195
13. Stickler, G. B. Familial hypophosphatemic vitamin D resistant rickets: the neonatal period and infancy. Acta Paediatr Scand 1969; 58:213-219
14. Fuente R, Gil-Peña H, Claramunt-Taberner D, Hernández O, Fernández-Iglesias A, Alonso-Durán L, et al. X-linked hypophosphatemia and growth. Rev Endocr Metab Disord 2017; 18:107-115
15. Ziviþnjak M, Schnabel D, Billing H, Staude H, Filler G, Querfeld U, et al. Age-related stature and linear body segments in children with X-linked hypophosphatemic rickets. Pediatr Nephrol 2011; 26:223-231
16. Mäkitie et al. Early treatment improves growth and biochemical and radiographic outcome in X linked hypophosphatemic rickets. J Clin Endocrinol Metab 2003; 88: 3591-3597
17. Steendijk R, Hauspie RC. The pattern of growth and growth retardation of patients with hypophosphataemic vitamin D-resistant rickets: a longitudinal study. Eur J Pediatr 1992; 151:422-427
18. Rothenbuhler A, Schnabel D, Högler W, Linglart A. Diagnosis, treatment-monitoring and follow-up of children and adolescents with X-linked hypophosphatemia (XLH). Metabolism 2020; 103S:153892
19. Lambert AS, Zhukouskayac V, Rothenbuhler A ,Linglart A. X-linked hypophosphatemia: Management and treatment prospects. Joint Bone Spine 2019; 86: 731-738
20. Santos F. Raquitismo hipofosfatémico. An Nefrol Pediatr 2021; 1:10-15
21. Gladding A, Szymczuk V, Auble BA , Boyce AM. Burosumab treatment for fibrous dysplasia. Bone 2021; 150:116004
22. Haffner D, Emma F, Eastwood DM, Duplan MB, Bacchetta J, Schnabel D, et al. Clinical practice recommendations for the diagnosis and management of X-linked hypophosphataemia. Nat Rev Nephrol 2019; 15:435-455
23. Trombetti A, Al-Daghri N, Brandi ML, Cannata-Andía JB, Cavalier E, Chandran M et al. Interdisciplinary management of FGF23-related phosphate wasting syndromes: a Consensus Statement on the evaluation, diagnosis and care of patients with X-linked hypophosphataemia. Nat Rev Endocrinol 2022; 18:366-384
24. Seikaly MG, Baum M. Thiazide diuretics arrest the progression of nephrocalcinosis in children with X-linked hypophosphatemia. Pediatrics 2001; 108:E6
25. Ræder, H., Shaw, N., Netelenbos, C. & Bjerknes, R. A case of X-linked hypophosphatemic rickets: complications and the therapeutic use of cinacalcet. Eur J Endocrino 2008; 159 Suppl1:S101-105
26. Warady BA, Iles JN, Ariceta G, Dehmel B, Hidalgo G, Jiang X et al. A randomized, double-blind, placebo-controlled study to assess the efficacy and safety of cinacalcet in pediatric patients with chronic kidney disease and secondary hyperparathyroidism receiving dialysis. Pediatr Nephrol 2019; 34:475-486
27. Gray RW, Garthwaite TL. Activation of renal 1,25-dihydroxyvitamin D3 synthesis by phosphate deprivation: evidence for a role for growth hormone. Endocrinology 1985; 116:189-193
28. Živiþnjak M, Schnabel D, Staude H, Even G, Marx M, Beetz R et al. Three-year growth hormone treatment in short children with X-linked hypophosphatemic rickets: effects on linear growth and body disproportion. J Clin Endocrinol Metab 2011; 96:E2097-105
29. Meyerhoff N, Haffner D, Staude H, Wühl E, Marx M, Beetz R, et al. Effects of growth hormone treatment on adult height in severely short children with X-linked hypophosphatemic rickets. Pediatr Nephrol 2018; 33:447-456
30. Lambert AS, Zhukouskaya V, Rothenbuhler A, Linglart A. X-linked hypophosphatemia: Management and treatment prospects. Joint Bone Spine 2019; 86:731-738
31. Carpenter TO, Imel EA, Ruppe MD, Weber TJ, Klausner MA, Wooddell MM et al. Randomized trial of the anti-FGF23 antibody KRN23 in X-linked hypophosphatemia. J Clin Invest 2014; 124:1587-1597
32. Carpenter TO, Whyte MP, Imel EA, Boot AM, Högler W, Linglart A, et al. Burosumab Therapy in Children with X-Linked Hypophosphatemia. N Engl J Med 2018; 378:1987-1998
