Félix Sánchez-Valverde1, Verónica Etayo2, Luis Peña Quintana3
1Servicio de Pediatría. Hospital Universitario de Navarra, Pamplona. Investigador Emérito: Navarra BIOMED. Grupo Gendina. Profesor Honorífico de la Facultad de Medicina de la Universidad Pública de Navarra, Pamplona
2 Pediatra. Centro de Salud de San Juan. Servicio Navarro de Salud
3 Jefe Sección Gastroenterología, Hepatología y Nutrición Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil. CIBER-OBN ISCIII. Universidad de Las Palmas de Gran Canaria
Resumen
Se describe la fisiología de la Tolerancia inmunológica Oral (TO) de las proteínas de los alimentos y de la microbiota residente. A continuación, se analizan los cuadros clínicos más destacados en la edad pediátrica, caracterizados por la pérdida de TO a diversos alimentos y a la microbiota intestinal. Entre estos cuadros tenemos la Alergia a proteína de leche de vaca, la Enfermedad Celiaca (EC) y otras intolerancias al gluten, los Trastornos Gastrointestinales Eosinofílicos Primarios (TGIEP) y la Enfermedad Inflamatoria Intestinal (EII). Se hace una pequeña descripción de estos cuadros clínicos, destacando la sintomatología de sospecha, epidemiología, el diagnóstico diferencial y tratamiento. Estas enfermedades están aumentando en la edad pediátrica y es necesario que el pediatra de AP las tenga en cuenta en el día a día de su ejercicio clínico.
Introducción
La introducción de proteínas heterólogas en la dieta del niño supone una adaptación al carácter omnívoro de la especie humana. La mayoría de las veces se produce una TO a dicho alimento. En ciertas ocasiones, algunos niños con unas características genéticas de predisposición y algunos factores ambientales que lo favorecen, esta tolerancia no se adquiere o una vez adquirida se pierde. Esta situación se puede dar en los contactos iniciales con el alimento o en épocas posteriores por una pérdida de la TO ya adquirida1.
Tolerancia oral
La función de todo el aparato digestivo en el proceso y digestión de los alimentos (cavidad oral, intestino delgado, intestino grueso, hígado y páncreas) es bien conocida. Desde hace ya varias décadas sabemos, también, que diversas partes del tubo digestivo a través de sus mucosas (sobre todo el intestino delgado) tienen una función muy importante en el fenómeno de la TO. Este proceso de reconocimiento y tolerancia de antígenos propios de los alimentos y microorganismos, es lo que garantiza que proteínas heterólogas sean toleradas por el individuo. Todo este proceso está regulado por la inmunidad innata y la inmunidad adaptativa2-4.
La TO es la tolerancia a antígenos externos que ingresan al organismo por vía oral. Se ha clasificado específicamente como una supresión específica de la respuesta inmune tanto celular como humoral a dicho antígeno, que muchas veces va a ser un alimento.
Un hecho fundamental es que el primer contacto con estas proteínas heterólogas de origen alimentario se da en la época de lactante, sobre todo a partir de la introducción de la proteína de la leche de vaca y de la posterior diversificación de la dieta a partir de los seis meses con la alimentación complementaria.
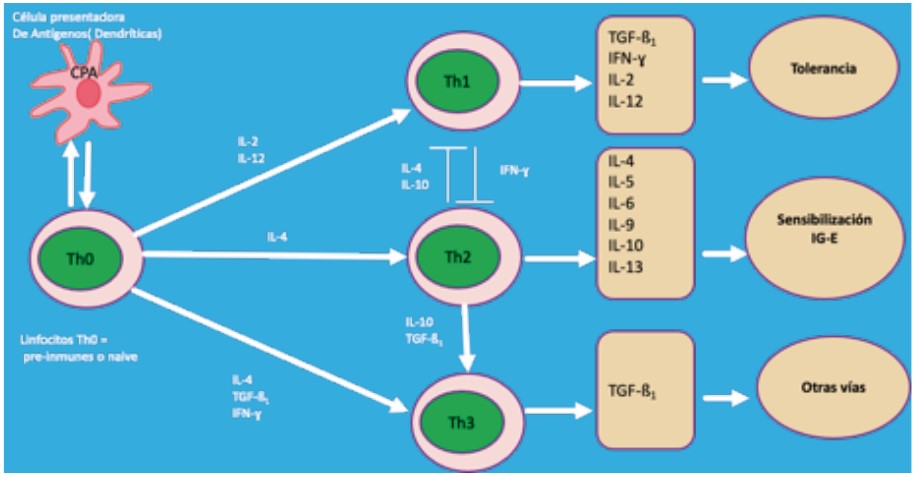
En la figura 1 se puede observar cómo se produce de forma fisiológica el fenómeno de la tolerancia oral a alimentos. Básicamente, la TO se caracteriza por una respuesta supresora mediada por linfocitos T supresores TH1 que mediante la activación de diversas citocinas supresoras inducen la tolerancia, controlando también la respuesta humoral de tipo IgE. La TO está relacionada con factores genéticos, edad del paciente, dosis y forma del antígeno. La IgA es la barrera inmunológica natural de este sistema (inmunidad innata) y está relacionada con la falta de respuesta inmune a los no patógenos. Hay una serie de células del sistema inmune intestinal que funcionan como células presentadoras de antígenos. Además, la microbiota tiene un papel muy importante como coadyuvante en procesos inmunológicos del intestino y, por extensión, en la TO5.
Las citocinas de tipo Th1 son importantes promotores de la respuesta inmune mediada por células, mientras que las citocinas Th2 inducen la respuesta inmune mediada por anticuerpos. Y ambas respuestas mediadoras se auto equilibran entre ellas.
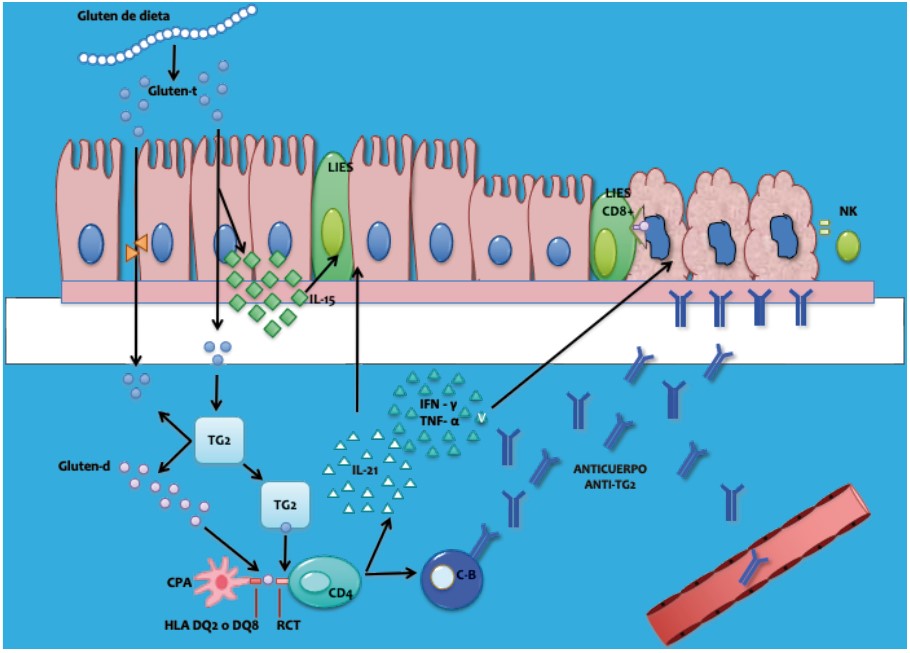
En el caso de la enfermedad celiaca, la perdida de tolerancia al gluten es por un mecanismo mixto, celular y humoral. El proceso se inicia por un problema de permeabilidad intestinal y la acción de la transglutaminasa 2 (TG 2) que produce el gluten desamidado que posteriormente a través de las CPA es presentado a los linfocitos CD4 con la colaboración del HLA DQ2 o DQ8. Como resultado final se producirá daño celular (atrofia vellositaria) y la producción de anticuerpos IgA antiTG2, marcadores específicos de la enfermedad celiaca que pasan al torrente sanguíneo (figura 2)6.
Características especiales en pediatría
Como ya hemos comentado en la edad pediátrica debutan con mucha frecuencia estas pérdidas de TO. Algunas situaciones de pérdida de TO desaparecen con la edad, al estar relacionadas con la inmadurez de las funciones digestivas y la falta de habilidades inmunológicas para afrontar estas situaciones en los primeros meses de vida. La capacidad de hidrolisis por la falta de actividad de las proteasas y la falta de acidez gástrica en el estómago del lactante, son responsables de que la persistencia de epitopes en las proteínas sean más frecuentes. Por este motivo, algunas pérdidas de TO se recuperan cuando el niño se hace mayor, debido a factores que han participado en la fase de sensibilización, como son la cesárea y la falta en el recién nacido de la microbiota bifidógena de la vagina7.
Por otra parte, es importante el conocimiento del cronograma en la diversificación alimentaria, para poder detectar posibles cuadros de alergia o intolerancia. En cualquier caso, la perdida de TO se puede detectar en épocas posteriores al contacto inicial con el antígeno alimentario, al coincidir ciertas situaciones ambientales y ciertos tipos de alteración de la salud. Además, hay que recordar, que en ocasiones el intervalo entre contacto con el antígeno y aparición de síntomas no es in inmediato pudiendo transcurrir un periodo de tiempo corto (IgE mediadas, FPIES), intermedio (EC, EII, IgE no mediada) y largo (SGNC, trastornos eosinofílicos).
Perdida de tolerancia oral a la proteína de leche de vaca
4.1. Alergia a proteína de leche de vaca (APLV) IgE mediada
Definición. La alergia a leche de vaca es la causa de alergia a alimentos más frecuente en niños menores de un año. Suele coincidir con el inicio de la lactancia artificial y la mitad de las reacciones alérgicas a la leche de vaca se dan en los dos primeros años de vida. Los síntomas de alergia mediada por IgE a leche aparecen a los pocos minutos de la ingesta de leche, casi siempre antes de transcurrida una hora.
Epidemiologia. Se trata de la alergia alimentaria más frecuente en niños menores de un año y tiene una prevalencia estimada por autodiagnóstico del 1,7 %, y confirmada por profesionales entre 0,5 % y 2,2 %8.
Clínica. La sintomatología más frecuente es la siguiente:
Síntomas cutáneos: prurito (localizado o generalizado), urticaria (habones) y angioedema
- Síndrome de alergia oral (SAO) definido como prurito orofaríngeo inmediato tras la ingestión de un alimento, con o sin lesiones peribucales y/o ligero edema de labios
- Síntomas digestivos: náuseas, vómitos, dolor epigástrico, dolor abdominal tipo cólico, diarrea. En niños pequeños, rechazo alimentario
- Síntomas respiratorios. Son menos frecuentes
- Síntomas cardiovasculares: taquicardia, palpitaciones
- Otros síntomas posibles: malestar, astenia intensa, sensación de calor generalizado, desorientación, sudoración, convulsiones, incontinencia urinaria o rectal, contracciones uterinas con o sin metrorragia
La reacción alérgica sistémica grave, de instauración rápida y potencialmente mortal que ocurre tras el contacto con un alérgeno se conoce como anafilaxia y aunque es excepcional se puede ver en APLV IgE mediada en lactantes.
Tratamiento y comentarios. El tratamiento en nuestro medio suele ser las Fórmulas Hidrolizadas de Alto grado (FHAG) de proteínas de origen lácteo o de arroz, y las fórmulas de soja (FS) a partir de los seis meses de edad. En caso de un alto grado de sensibilización y clínica grave al debut, se aconseja iniciar el tratamiento con Formula Elemental de aminoácidos (FE) y, también, si no responden adecuadamente al tratamiento con FAGH o FS. Hay ciertos marcadores biológicos iniciales (IgE total, IgE especifica contra caseína) que nos orientan sobre aquellos niños que van a desarrollar una Marcha Alérgica. Estos pacientes deben ser controlados con más intensidad dada su tendencia a la misma9.
4.2. APLV no mediada por IgE
Definición. La APLV‑no IgE mediada es una reacción adversa que aparece tras el consumo de leche de vaca, en cantidades habitualmente toleradas por sujetos sanos, caracterizada por ser reproducible e implicar presuntamente en su desarrollo uno o varios mecanismos inmunológicos no mediados por anticuerpos de clase IgE10.
Epidemiología. La prevalencia de APLV no mediada por IgE es difícil de calcular, dado que las condiciones clínicas y diagnosticas varían mucho entre los diversos estudios. En una serie israelí, con una metodología de estudio reglada, se ha calculado la prevalencia de FPIES (food protein-induced enterocolitis síndrome) en pediatría en un 0,34 % y en general en series que incluyen ambos tipos de, APLV, IgE mediada e IgE no mediada, se calcula que un 60 % pertenecen al primer grupo11. La prevalencia de la, hace años llamada Intolerancia a Proteinas de leche de vaca, ha ido disminuyendo con los años probablemente debido a la promoción de la LM y otras medidas generales de terapia nutricional y en los últimos años se han referido más cuadros de PIES y Colitis Eosinofilica12.
Clínica10. No existen guías clínicas ni criterios diagnósticos específicos para la Proctocolitis por PLV y para la Enteropatía Inducida por PLV. El diagnóstico se basa en la historia clínica y en los síntomas (tablas I y II).
Con respecto a FPIES, existen una Guías Cínicas publicadas y modificadas en el documento de consenso español10 (tabla III).
Tratamiento. El tratamiento será la exclusión de la dieta de la PLV: FAGH, FS y FE, durante un periodo de 3-4 semanas con realización posterior de prueba de provocación que en el caso de ser un FPIES será a nivel hospitalario y con una serie de medidas de precaución. En caso de ser positiva la prueba de provocación dejar entre 6 meses y 12 meses según la edad del niño y la intensidad del cuadro clínico. Hay que recordar que existe la posibilidad de que los alérgenos alimentarios, sobre todo en niños que ya han diversificado la dieta, puedan ser otros que la PLV, sobre todo en el caso de FPIES.
Perdida de tolerancia al gluten [enfermedad celiaca, sensibilidad al gluten no celiaca y alergia al gluten (IgE mediada)]
5.1. Enfermedad celiaca (EC)
Definición. Intolerancia al gluten permanente mediada por mecanismo inmunológico que causa una lesión intestinal y que se desarrolla en pacientes con predisposición genética (Fenotipo DQ2 y DQ8). La característica de esta enfermedad es que tiene básicamente dos formas de presentación clínica: una clásica o digestiva de debut más precoz y, otra, prácticamente asintomática o paucisintomática. Los criterios diagnósticos han variado en la última revisión básicamente en dos conceptos: no es necesario en todos los casos la realización de biopsia ni el estudio HLA. Sigue siendo necesario y obligatorio en todos los casos, ante la sospecha de EC, que sea evaluado por un especialista en Gastroenterología y Nutrición Pediátrica con experiencia en EC para evitar tanto el sobre diagnóstico como el infra diagnóstico13,14.
Epidemiologia. Las cifras actuales varían entre 1,2 -2,5 /100 en países de Europa, y cifras más bajas en otras zonas del mundo debido al no consumo de trigo y la baja densidad de DQ2 15,16. La alta presencia de fenotipo DQ2 puedes estar relacionada con la prevalencia de EC17.
Clínica. En la forma clásica predomina la clínica digestiva: diarrea crónica, distensión abdominal y pérdida de peso, mientras las formas asintomáticas hay que detectarla a través de estudio de grupos de riesgo y/o estando atento a algunos síntomas que pueden estar relacionados con la EC18.
Tratamiento. En el momento actual no existe otra alternativa que la exclusión del gluten en la dieta de los pacientes con EC. Hay algunas alternativas terapéuticas que se están investigando, pero que actualmente no están en el espectro real de opciones para los enfermos19.
5.2. Sensibilidad al gluten no celiaca o Intolerancia al Trigo (IT)
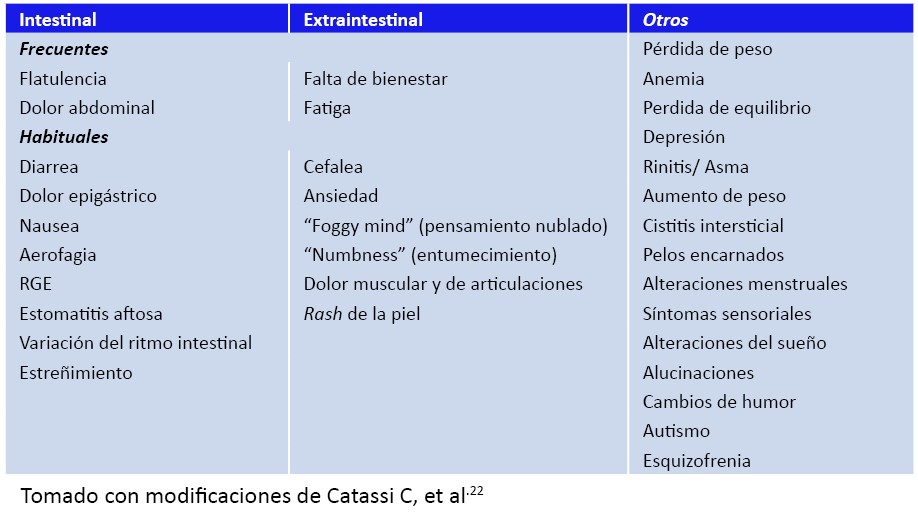
Definición. La sensibilidad al gluten no celiaca (SGNC) es una entidad emergente caracterizada, por síntomas gastrointestinales y extraintestinales dependientes del gluten en pacientes no celiacos. El agente causal es desconocido y no existen criterios diagnósticos consensuados. Bajo la denominación de SGNC se han incluido pacientes con potenciales formas menores de EC o con síndrome de intestino irritable sin percepción de intolerancia al gluten, pero respondedores a la dieta sin gluten20.
Epidemiologia. Se han referido cidras de prevalencia en la población general entre 0,97 % y 13 % y esto se debe a que la consideración de lo que realmente es la SGNC no es considerada de la misma forma por todos los autores21. No existen datos epidemiológicos en pediatría y, en todo caso parece menos frecuente.
Clínica. Se han relacionado con la SGNC varios cuadros clínicos tanto digestivos, como generales (tabla IV).
Tratamiento y comentarios. Dieta sin gluten con evaluación clínica de la respuesta y pruebas de provocación periódicas. Aunque no se conocen los mecanismos etiopatogénicos y se trata de una enfermedad en fase de descubrimiento, algunos autores hablan de la importancia de considerarla entre loxds casos de intestino irritable23.
5.3. Alergia tipo IgE al gluten
Se trata de una alergia alimentaria mediada por IgE, con toda la sintomatología clásica de las alergias alimentarias de este tipo (Ver “Clínica de APLV IgE mediada”). Es poco frecuente.
Tratamiento. Dieta sin gluten de la misma manera que en la enfermedad celíaca.
Pérdida de la tolerancia a diversas proteínas de la dieta
6.1. Trastornos eosinofílicos24-26
Definición. Los trastornos gastrointestinales eosinofílicos primarios (TGEIP) son un grupo heterogéneo de enfermedades que se definen como una inflamación rica en eosinófilos de uno o varios tramos del tubo digestivo. Los cuadros clínicos que abarca este concepto son: Esofagitis eosinofilica, Gastroenteropatia eosinofilica y Colitis eosinofilica.
Clínica. La clínica varía desde dolor abdominal, vómitos, diarrea, intolerancia alimentaria, disfagia, impactación alimentaria, malabsorción, enteropatía pierde-proteínas, fallo de medro o rectorragia, entre otros.
6.1.1. Esofagitis Eosinofilica (EEo)24-27
Definición. enfermedad esofágica mediada por alergenos caracterizada clínicamente por síntomas relacionados con disfunción esofágica e histológicamente por eosinófilos predominantes y signos de inflamación.
Clínica. En la lactancia y niños pequeños pueden presentar síntomas inespecíficos con dificultades de alimentación (incluyendo vómitos, regurgitación y rechazo de la alimentación), lo que puede ocasionas un cuadro clínico de fallo de medro. En niños mayores y adolescentes los síntomas suelen ser: vómitos, dolor abdominal, dolor retroesternal, síntomas de Enfermedad por Reflujo Gastro Esofágico (ERGE), disfagia e impactación alimenticia.
Epidemiología. Es más frecuente en hombres (3:2) y en países industrializados. Es frecuente constatar una historia familiar de alergia hasta en el 70 % de los casos y de TGEIP en el 10 %. La incidencia en pediatría varía entre 0,7-10 por 100.000/año y la prevalencia 0,2-43/100.000 28. Recientemente, en un estudio poblacional realizado en Dinamarca la incidencia de EEo en la edad pediátrica fue una cuarta parte de la incidencia en adultos de 40 a 64 años: 4,4 (IC del 95 % 3,2 a 5,6) versus 17,6 (IC del 95 % 15,7 a 19,5) por 100 000 años-persona. Los autores sugieren la posibilidad de que haya un infra diagnóstico en la edad pediátrica29.
Tratamiento
- Tratamiento farmacológico: corticoides, supresión de la acidez para controlar la ERGE que suele coexistir en muchas ocasiones con la EEo (inhibidores de la bomba de protones)
- Tratamiento dietético
- Dilataciones esofágicas
- Se han utilizado ocasionalmente anticuerpos monoclonales (mepolizumab y reslizumab), y anti-IL13 y anti-receptor-IL-4, y otros anticuerpos. El que mejores resultados ha tenido hasta ahora sido el Dopilumab24.
6.1.2. Gastroenteropatia eosinofilica (GEEo)
La GEEo consiste en la infiltración de una o varias capas del tracto gastrointestinal, excluyendo otras enfermedades que cursan con eosinofilia tisular digestiva, que puede afectar desde el esófago hasta el recto. Por este motivo, se suele subdividir en gastritis, enteritis o gastroenteritis eosinofílica.
La prevalencia global de GEEo y CEo es de 28/100.000 en USA30.
El tratamiento es similar a la EEo.
6.1.3. Colitis Eosinofílica (CEo)
Definición. La CEo se define como la infiltración eosinofílica exclusivamente colónica, en ausencia de otras causas de eosinofilia intestinal. Hay que diferenciar la afectación en neonatos y lactantes conocida como Proctocolitis alérgica o eosinofílica y la afectación del niño mayor y adolescente.
La Proctocolitis eosinofílica es una entidad emergente y se ha hablado de ella en el apartado de APLV no mediada por IgE.
Clínica. Cursa con emisión de heces con sangre y moco sin otros síntomas, con buen estado general y desarrollo peso y longitud normal. Raramente cursa con anemia o hipoalbuminemia. Es la causa más frecuente de rectorragia en esta etapa de la vida11.
Tratamiento. Exclusión de los alergenos alimentarios identificados en la dieta del lactante y Dieta Elemental su fuera necesario. Los alimentos más implicados son PLV, soja y huevo y, en ocasiones, pueden no tolerar los FHAG por identificación de restos de epitopes de la PLV.
6.1.4. Colitis eosinofilica (CEo) del niño mayor y adolescente
Este cuadro clínico es menos conocido, está peor definido y es mucho menos frecuente.
Clínica. Rectorragias, dolor abdominal, pérdida de peso, anorexia y diarrea. El diagnostico diferencial en un cuadro clínico de estas características incluye descartar Colitis ulcerosa y la Enfermedad de Crohn. La Eosinofilia periférica y la anemia ferropénica pueden ser orientadoras, pero no son específicas.
Tratamiento. La CEo en niños mayores se trata igual que en la EEo. Si se detectan alergias alimentarias habrá que excluir los alimentos detectados de la dieta y valorar la evolución. En caso de ausencia de mejoría o si no se detectan alérgenos alimentarios el tratamiento habitual es corticoide por vía general (prednisona oral a 1-2 mg / kg / día, o budesonida de liberación íleo-cólica a la dosis de 6 mg/día). Es posible también el tratamiento local con corticoides y si la evolución no es buena se puede recurrir a otros inmunosupresores.
Epidemiología. Tanto de la GEEo como de la CEo, no existen cifras fiables de epidemiologia en pediatría.
Enfermedad inflamatoria intestinal31-33
Definición. La enfermedad inflamatoria intestinal es una inflamación crónica de distintos tramos del tubo digestivo que alterna periodos de remisión clínica con otros de actividad. La fisiopatología de la EII consiste en una respuesta inflamatoria aumentada frente a la propia microbiota intestinal de aquellos pacientes que presentan predisposición genética. En la actualidad, la etiología de la EII se considera multifactorial.
Los cuadros clínicos encuadrados en EII son la Enfermedad de Crohn (ECr), la Colitis Ulcerosa (CU) y la EII no clasificada.
Epidemiologia. La incidencia de EII en la edad pediátrica se encuentra en ascenso progresivo en los últimos años (7-5 pacientes/100.000 habitantes). El 30 % de EII se diagnostican en la edad pediátrica. El estudio SPIRIT, trabajo colaborativo de población pediátrica con EII, mostraba como la incidencia de la EC en menores de 18 años entre 1996 y 2009 prácticamente se triplicó (de 0,53 a 1,7 casos/105 habitantes)34. En un estudio realizado hace unos años sobre la EII pediátrica en el norte de España, se comprobó una gradiente descendente de Norte a Sur y de zonas más industrializadas a menos industrializadas35.
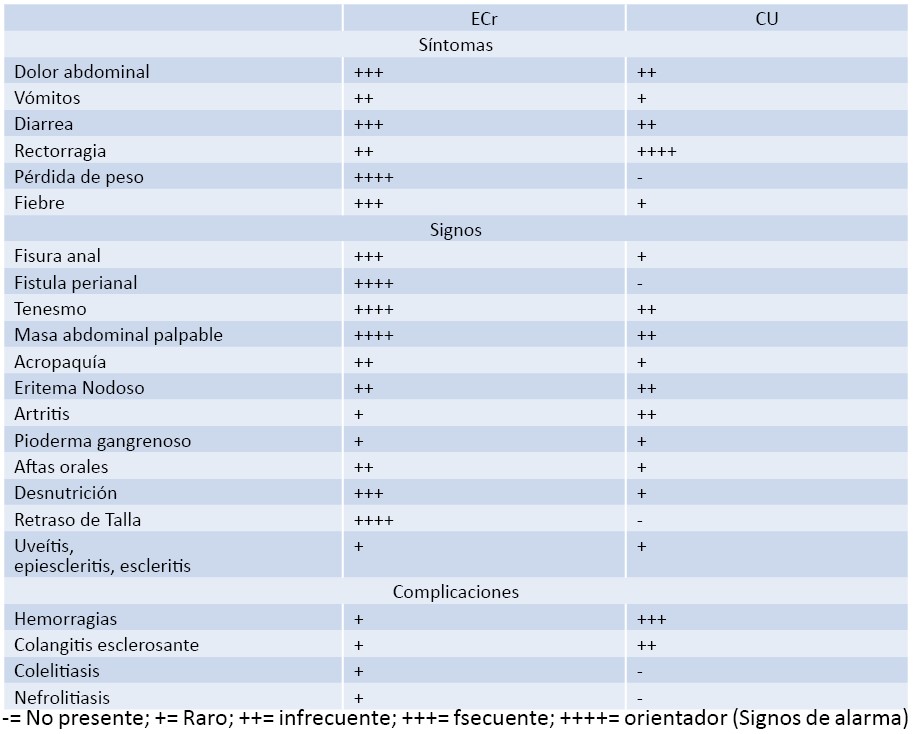
Clínica. Aunque la clínica en ocasiones puede estar solapada entre las entidades descritas que comprenden la EII en pediatría, existe algunas diferencias que nos pueden orientar inicialmente en el sentido sobre todo de si nos encontramos ante una ECr o una CU (Tabla V).
Los síntomas más frecuentes de la CU son diarrea sanguinolenta con urgencia y tenesmo, abdominalgia, fiebre y pérdida de peso. Se consideran signos graves: fiebre elevada, afectación del estado general, retraso del crecimiento, distensión abdominal, timpanismo y dolor a la palpación abdominal.
En la ECr estos síntomas son abdominalgia (a menudo posprandial de tipo cólico, periumbilical o en cuadrante inferior derecho), diarrea y retraso del desarrollo. El comienzo es con frecuencia insidioso en forma de anorexia, astenia, fiebre intermitente, estacionamiento pondero estatural y manifestaciones articulares, orales o cutáneas. En ocasiones, se manifiesta como un episodio agudo de dolor en cuadrante inferior derecho que puede remedar una apendicitis. La rectorragia es menos frecuente que en la CU, excepto en las formas de afectación cólica. Existe una lesión perianal en forma de fisura, fístula, o absceso en un 25-50 % de los pacientes.
El diagnóstico se basa en la anamnesis, exploración física, parámetros analíticos en sangre y heces, y estudio confirmatorio mediante endoscopia e histología. Es importante en Atención Primaria valora algunos signos de alarma para la derivación del paciente para su estudio a un servicio de Gastroenterología y Hepatología Pediátrica. Debemos tener presente que la EII es una entidad presente en nuestro medio y con una tendencia a subir su incidencia34,36.
Tratamiento
Enfermedad de Crohn. Los tratamientos que han demostrado tener algún grado de evidencia son: Nutrición Parenteral, Nutrición enteral exclusiva, mesalazina, budesonida, prednisolona/metilprednisolona, antibióticos, probióticos, azatioprina/6-mercaptopurina, metotrexato, talidomida, infliximab, afdalimumab y otros biológicos.
Colitis ulcerosa. Los tratamientos que han demostrado eficacia son: aminosalicilatos (mesalazina), corticoides parenterales orales o locales, inmunosupresores como tiopurinas en (fase de mantenimiento), tacrolimus y ciclosporina (fase aguda) y el tratamiento con Biológicos, antibióticos, probióticos y granulocitoferesis.
En ambos casos en caso de fracaso del tratamiento médico debido tanto a complicaciones, como la falta de respuesta al tratamiento médico es posible el tratamiento quirúrgico32,37.
Conclusiones
La pérdida de TO intestinal es una entidad que presenta en pediatría un escenario imprevisible en su desarrollo. La influencia selectiva que tienen en estos casos, tanto los factores genéticos como los ambientales, establecen un pronóstico muy diferente dentro de cada entidad clínica y de cada individuo. Podemos tener un comienzo agudo, subagudo o crónico, que en ocasiones puede evolucionar hacia la recuperación de la TO (APLV IgE mediada y cesárea) y APLV IgE no mediada. Sin embargo, otras veces, esta pérdida de TO es para siempre (EC) y en otras ocasiones la evolución es crónica y por brotes, sin mucha capacidad por nuestra parte de influir en la evolución, como sucede en la EII. La pérdida de TO en su conjunto es una situación epidemiológicamente en crecimiento en nuestra sociedad y es cada vez más frecuente. Nuestra capacidad de intervención en este proceso es por una parte pensar en ellas para tener la posibilidad de diagnosticarlas, y por otra parte, a nivel preventivo, actuando al máximo sobre aquellos factores ambientales, que pueden influir en estas enfermedades.
Bibliografia
- D. ML. Mucosal. Inmunity:An Overview. En: Leung DYM SH, Geha RS, Szefler SJ., editor. Allergy Principles and Practice. St. Louis Missouri. USA2003. p. 473-7.
- Walker -Smith J MM. Diseases of the Small Intestine in Childhood. Oxford OX1 1ST , UK: Isis Medical Media; 1999.
- Tordesillas L, Berin MC. Mechanisms of Oral Tolerance. Clin Rev Allergy Immunol. 2018;55(2):107-17.
- Weiner HL, da Cunha AP, Quintana F, Wu H. Oral tolerance. Immunol Rev. 2011;241(1):241-59.
- Méndez CS, Bueno SM, Kalergis AM. Contribution of Gut Microbiota to Immune Tolerance in Infants. J Immunol Res. 2021;2021:7823316.
- Sanchez-Valverde F, Zarikian S, Etayo V. Nuevas estrategias terapéuticas en Enfermedad celíaca. En: Polanco I, ed. Enfermedad Celiaca. Presente y futuro. Edicion 2ª ed. Madrid: Ergon; 2017 pp. 127-35.
- Sanchez-Valverde F, Gil F, Martinez D, Fernandez B, Aznal E, Oscoz M, et al. The impact of caesarean delivery and type of feeding on cow’s milk allergy in infants and subsequent development of allergic march in childhood. Allergy. 2009;64(6):884-9.
- Flom JD, Sicherer SH. Epidemiology of Cow’s Milk Allergy. Nutrients. 2019;11(5).
- Gil F, Mendizabal M, Amezqueta A, Aznal E, Durá T, Sánchez-Valverde F. A new score to predict allergic march in patients with IgE-mediated cow milk allergy. Allergy Asthma Proc. 2019;40(3):187-92.
- Espín Jaime B, Díaz Martín JJ, Blesa Baviera LC, Claver Monzón Á, Hernández Hernández A, García Burriel JI, et al. [Non-IgE-mediated cow’s milk allergy: Consensus document of the Spanish Society of Paediatric Gastroenterology, Hepatology, and Nutrition (SEGHNP), the Spanish Association of Paediatric Primary Care (AEPAP), the Spanish Society of Extra-hospital Paediatrics and Primary Health Care (SEPEAP), and the Spanish Society of Paediatric ClinicaL Immunology, Allergy, and Asthma (SEICAP)]. An Pediatr (Engl Ed). 2019;90(3):193.e1-.e11.
- Katz Y, Goldberg MR, Rajuan N, Cohen A, Leshno M. The prevalence and natural course of food protein-induced enterocolitis syndrome to cow’s milk: a large-scale, prospective population-based study. J Allergy Clin Immunol. 2011;127(3):647-53.e1-3.
- Labrosse R, Graham F, Caubet JC. Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update. Nutrients. 2020;12(7).
- Husby S, Koletzko S, Korponay-Szabó I, Kurppa K, Mearin ML, Ribes-Koninckx C, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosing Coeliac Disease 2020. J Pediatr Gastroenterol Nutr. 2020;70(1):141-56.
- Román Riechmann E, Castillejo de Villasante G, Cilleruelo Pascual ML, Donat Aliaga E, Polanco Allué I, Sánchez-Valverde F, et al. [Rational application of the new European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) 2020 criteria for the diagnosis of coeliac disease]. An Pediatr (Engl Ed). 2020;92(2):110.e1-.e9.
- Singh P, Arora A, Strand TA, Leffler DA, Catassi C, Green PH, et al. Global Prevalence of Celiac Disease: Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2018;16(6):823-36.e2.
- Roberts SE, Morrison-Rees S, Thapar N, Benninga MA, Borrelli O, Broekaert I, et al. Systematic review and meta-analysis: the incidence and prevalence of paediatric coeliac disease across Europe. Aliment Pharmacol Ther. 2021;54(2):109-28.
- Sánchez-Valverde F, Martínez-Ojinaga E, Donat E, Bodas A, Bandrés E, Torres R, et al. “Geographical distribution of risk genotypes in pediatric patients with celiac disease in Spain”. Hum Immunol. 2023;84(4):290-5.
- Pérez Solís D, Cilleruelo Pascual ML, Ochoa Sangrador C, García Burriel JI, Sánchez-Valverde Visus F, Eizaguirre Arocena FJ, et al. Spanish National Registry of Paediatric Coeliac Disease: Changes in the Clinical Presentation in the 21st Century. J Pediatr Gastroenterol Nutr. 2022;74(6):805-11.
- Sanchez-Valverde F. Nuevas estrategias terapéuticas en EC. Edicion 2ª ed. Madrid: Ergon; 2017.
- Molina-Infante J, Santolaria S, Montoro M, Esteve M, Fernández-Bañares F. [Non-celiac gluten sensitivity: a critical review of current evidence]. Gastroenterol Hepatol. 2014;37(6):362-71.
- 21. Cárdenas-Torres FI, Cabrera-Chávez F, Figueroa-Salcido OG, Ontiveros N. Non-Celiac Gluten Sensitivity: An Update. Medicina (Kaunas). 2021;57(6).
- Catassi C, Elli L, Bonaz B, Bouma G, Carroccio A, Castillejo G, et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015;7(6):4966-77.
- Catassi C, Alaedini A, Bojarski C, Bonaz B, Bouma G, Carroccio A, et al. The Overlapping Area of Non-Celiac Gluten Sensitivity (NCGS) and Wheat-Sensitive Irritable Bowel Syndrome (IBS): An Update. Nutrients. 2017;9(11).
- Gutiérrez Junquera C, Fernández Fernández S, Domínguez-Ortega G, Vila Miravet V, García Puig R, García Romero R, et al. [Recommendations for the diagnosis and practical management of paediatric eosinophilic oesophagitis]. An Pediatr (Engl Ed). 2020;92(6):376.e1-.e10.
- Gutiérrez Junquera C, García Puig R, Fernández Fernández S. Trastornos gastrointestinales eosinofílicos primarios Madrid2023 [Available from: https://www.aeped.es/sites/default/files/documentos/04_trast_eosinofilicos.pdf.
- Peña L, Sánchez-Valverde F. Trastornos Gastrointestinales eosinofílicos primarios. In: Polanco I, editor. Atlas de Gastroenterología Pediátrica. 2ª ed. Madrid. Spain: Ergon; 2014. p. 159-69.
- Cilleruelo ML, Roman-Riechmann E, Sanchez-Valverde F, Donat E, Manuel-Ramos J, Martín-Orte E, et al. Spanish national registry of celiac disease: incidence and clinical presentation. J Pediatr Gastroenterol Nutr. 2014;59(4):522-6.
- Soon IS, Butzner JD, Kaplan GG, deBruyn JC. Incidence and prevalence of eosinophilic esophagitis in children. J Pediatr Gastroenterol Nutr. 2013;57(1):72-80.
- Allin KH, Poulsen G, Melgaard D, Frandsen LT, Jess T, Krarup AL. Eosinophilic oesophagitis in Denmark: Population-based incidence and prevalence in a nationwide study from 2008 to 2018. United European Gastroenterol J. 2022;10(7):640-50.
- Spergel JM, Book WM, Mays E, Song L, Shah SS, Talley NJ, et al. Variation in prevalence, diagnostic criteria, and initial management options for eosinophilic gastrointestinal diseases in the United States. J Pediatr Gastroenterol Nutr. 2011;52(3):300-6.
- van Rheenen PF, Aloi M, Assa A, Bronsky J, Escher JC, Fagerberg UL, et al. The Medical Management of Paediatric Crohn’s Disease: an ECCO-ESPGHAN Guideline Update. J Crohns Colitis. 2020.
- Rodríguez Martínez A, Velasco Rodríguez-Belvís M, VM. NLp. Enfermedad Inflamatoria Intestinal: Colitis Ulcerosa y enfermedad inflamatoria no clasificada 2023 [Available from: https://www.aeped.es/sites/default/files/documentos/17_eii.pdf.
- Martín de Carpi J, Viada Bris J, S. JnTo. Enfermedad de Crohn Madrid2023 [30 de mayo de 2023]. Available from: https://www.aeped.es/sites/default/files/documentos/16_enf_crohn.pdf.
- Martín-de-Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E. Increasing incidence of pediatric inflammatory bowel disease in Spain (1996-2009): the SPIRIT Registry. Inflamm Bowel Dis. 2013;19(1):73-80.
- Sánchez-Valverde F, Fernández P, Lozano M, Vitoria J, Sojo A, Garate J, et al. Estudio multicéntrico de 60 casos de enfermedad inflamatoria intestinal crónica en la infancia en el norte de España. Madrid: An Esp Ped . 1994; 1994. p. 435-42.
- ánchez-Valverde F, Etayo F, Aznal E. ¿Que no hacer en la enfermedad Inflamatoria en Pediatría? En: Sánchez C, editor. Enfermedad Inflamatoria Intestinal en Pediatría. Madrid: Ergon; 2013. p. 451-62.
- Sánchez C. Enfermedad Inflamatoria Intestinal en Pediatría. Madrid: Ergon; 2013.