Silvia Molo Amorós1, Álvaro Córdoba Oñate2, Andrea Martínez Serón1
1FEA de Unidad Alergología Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil de Canarias
2Pediatra de Atención Primaria. Centro de Salud de Guanarteme
Resumen
Las enfermedades alérgicas han aumentado de forma significativa en los últimos años y, con ello, los recursos dispuestos para comprender su inmunopatología con el objetivo de validar medidas de prevención y aportar nuevas opciones de tratamiento para disminuir carga de enfermedad, riesgos asociados y aumentar la calidad de vida de los pacientes.
Entre las posibles explicaciones de este incremento, se encuentran supuestos como la teoría de la higiene, que describe cómo los cambios derivados de los avances socioculturales, tecnológicos y de salubridad han podido influir en el aumento de la atopia. En base a hipótesis como esta, se han desarrollado multitud de líneas de investigación para esclarecer recomendaciones generales de puericultura. Así pues, actualmente existe evidencia de cómo la lactancia materna, el parto vaginal o la introducción precoz y mantenida de alimentos potencialmente alergénicos; previenen el desarrollo de alergia. Y, del mismo modo, han permitido encontrar nuevas alternativas terapéuticas, como el posible papel de los pre/probióticos o la revolución de la inmunoterapia en el tratamiento de la alergia alimentaria.
La inmunoterapia oral con alimentos se está instaurando en los últimos años como una opción de tratamiento, más allá de la convencional dieta con exclusión del alérgeno. El procedimiento cuenta con una elevada efectividad, aunque no está exenta de riesgos, presentando la mayoría reacciones alérgicas adversas durante su evolución.
En esta revisión se describen las principales características de alergias alimentarias más frecuentes en nuestro medio (APLV y AH). Así como las nuevas perspectivas en el manejo de la alergia alimentaria.
Palabras clave: alergia al huevo (AH), alergia a proteínas de la leche de vaca (APLV), inmunoterapia oral (ITO), microbioma
New challenges in the management of food allergy
Abstract
Allergic diseases have increased significantly in recent years. As a result, more resources are being allocated to understand the underlying immunopathology. The goal is to validate preventative measures and provide new treatment options to reduce the burden of disease and associated risks, and improve patients’ quality of life.
Among the possible explanations for this increment are theories such as the hygiene hypothesis, which describes how changes resulting from sociocultural, technological and health advances may have influenced the increase in atopy. Based on hypotheses like this, many lines of research have been developed to clarify general recommendations for child care. Thus, there is currently evidence that breastfeeding, vaginal delivery or the early and sustained introduction of potentially allergenic foods; can prevent the development of allergies. Similarly, new therapeutic alternatives have been found, such as the possible role of pre/probiotics or the revolution of immunotherapy in the treatment of food allergies
Oral immunotherapy (OIT) with food is being established in last years as a treatment option, beyond the conventional allergen-free diet. The procedure is highly effective, although it is not free of risks, most of them presenting adverse allergic reactions during its evolution.
This review describes the main characteristics of the most frequent food allergies in our environment (Cow´s milk allergy and allergy to egg). As well as the new perspectives in the management of food allergy.
Key words: allergy to egg, cow´s milk allergy, oral inmunotherapy, microbiome
Introducción
El importante incremento en la prevalencia y la gravedad de las enfermedades alérgicas en las últimas décadas, ha puesto el foco en el estudio de los diversos factores ambientales sobre la susceptibilidad genética: la dieta, las infecciones, la contaminacion del aire y la higiene. Por ello, analizar los mecanismos fisiopatológicos con el propósito de encontrar estrategias terapéuticas y preventivas en el desarrollo de alergias, se ha convertido en uno de nuestros principales objetivos1,2.
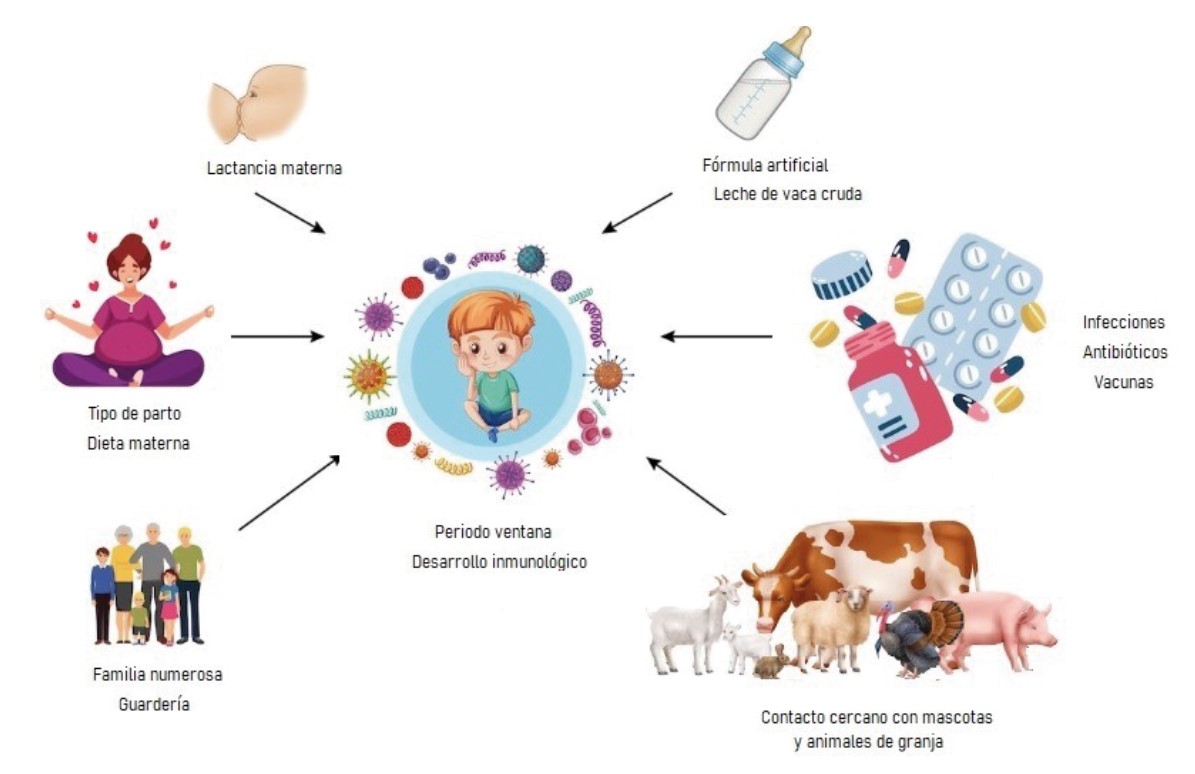
La teoría de la higiene se trata de un enfoque evolucionista que intenta explicar el aumento de las enfermedades alérgicas y autoinmunes en los últimos años en el mundo desarrollado. El sistema inmunológico se ha ido adaptando a nuestro entorno, con especial relevancia en esta teoría para la microbiota y los microorganismos ambientales que la regulan. Inicialmente se basaba en una dicotomía inmunológica, postulaba que cuando hay un entorno libre de gérmenes (uso de antibióticos, vacunas, cesárea, niveles bajos de lactobacilos y bacteroides, entre otros), se induce a una respuesta Th2 que da lugar a enfermedades alérgicas y autoinmunes, a causa de una falta de estimulación Th1. Por el contrario, la colonización temprana del tracto digestivo, las infecciones precoces, la presencia de hermanos mayores y mascotas en el domicilio, la asistencia a guarderías, la infección por hepatitis A o vivir en granjas; predispone a una respuesta protectora por estimulación Th13-6.
En la hipótesis de la higiene revisada, se ha añadido la diversificación en otras 2 estirpes de células CD4+. La célula Th17, que es capaz de inhibir y a la vez, ser inhibida por Th1 y Th2. Forma parte de la respuesta en infecciones de bacterias extracelulares y hongos, a la vez pueden desempeñar un efecto proinflamatorio. La cuarta posibilidad es la diferenciación de las células CD4+ a un fenotipo regulador (Treg) con función antiinflamatoria7.
Por tanto, la alergia no se produce por una respuesta Th2 aislada, sino probablemente a la activación conjunta de Th2 y Th17 inflamatoria que hace clínicamente visible la respuesta a alérgenos (figura 1).
A favor de esta teoría se encuentran los estudios que se han realizado en la comunidad amish frente a los huteritas, a los cuales se encuentran relacionados genéticamente. El estilo de vida de los Amish, alejados de las ciudades, la tecnología y en un ambiente con endotoxinas bacterianas significativamente mayor, se relacionó con una prevalencia de asma 4-6 veces menor8. Tanto la exposición mantenida como los estímulos bacterianos repetidos, no necesariamente por gérmenes patógenos, garantizarían una adecuada maduración del sistema inmunitario y una correcta inmunorregulación futura. Así, dentro de las posibles estrategias para evitar la historia natural de la atopia, se ha postulado inducir una microbiota diversa y promover la exposición a endotoxinas bacterianas como en ambientes de granjas, con animales domésticos y familias numerosas.
Estrategias preventivas para evitar la historia natural de atopia
El microbioma hace referencia a la suma de microorganismos, sus elementos genómicos y su interacción en un nicho ecológico determinado (piel, tracto digestivo, respiratorio). En relación a este, se han identificado factores protectores de alergia como la lactancia materna, el parto vaginal o la prevención del uso de antibióticos en los dos primeros años de vida. El uso de prebióticos y probióticos es un importante campo de investigación, por ejemplo, la suplementación de lactobacillus rhamnosus combinado con fórmula de caseína extensamente hidrolizada, aumentó las tasas de resolución de la alergia a las proteínas de leche de vaca en comparación con un grupo de control, que recibió la fórmula hidrolizada sin suplemento probiótico. Por otro lado, existen factores que inducen cambios en la composición de la microbiota intestinal, generando una disbiosis vinculada a un mayor riesgo de enfermedad alérgica. Otros elementos en estudio no han presentando una clara evidencia en su relación con la prevención del desarrollo de alergias, como el uso de emolientes en la dermatitis atópica, que disminuyó la gravedad de la misma, pero no el desarrollo de enfermedad alérgica, o la suplementación con vitamina D9-11).
En cuanto a las medidas dietéticas para la prevención de enfermedades alérgicas, se recomienda la lactancia materna exclusiva hasta los 4-6 meses, por su efecto prebiótico favorable sobre el microbioma intestinal y el desarrollo inmunológico del lactante. También el consumo de fibra fermentable, cuya fermentación produce ácidos grasos de cadena corta, que contribuyen a mitigar la respuesta alérgica. El estudio LEAP marcó un hito en la prevención de la alergia al cacahuete, y los posteriores estudios EAT y PETIT en la del huevo en pacientes de riesgo (dermatitis atópica, sensibilizados u otras alergias alimentarias). En ellos se establece que la introducción temprana (entre los 6-7 meses) frente a la tardía (más allá del año), supondría una reducción relativa en la prevalencia de alergia al cacahuete de hasta el 86% en población no sensibilizada. Existe pues suficiente evidencia científica que demuestra que la introducción temprana de cacahuete y huevo cocinado evita el desarrollo de alergia a los mismos, cambiando las guías de recomendación a nivel mundial. El inicio de la alimentación complementaria se trata de un periodo ventana inmunológico en el cual la ingesta de estos alimentos promueve el desarrollo de tolerancia permanente. Retrasar pues la introducción de alimentos alergénicos a día de hoy está contraindicado y se postula como otra de las causas del incremento de la alergia alimentaria12-13.
Siguiendo los pasos de estos estudios, en un intento de reducir la principal causa de alergia alimentaria en nuestro medio, la alergia a las proteínas de leche de vaca (APLV), se han realizado diferentes estudios proponiendo una introducción temprana y permanente del alérgeno como elemento protector. Un ensayo clínico reciente realizado en Japón, en el que introduce en la alimentación al menos 10 ml leche de vaca diarios entre los meses 1-2 de vida, sin interferencia con la lactancia materna, objetivó un descenso del 6 % el desarrollo de alergia a la leche de vaca14. Esto podría suponer el primer paso de un cambio de paradigma en la prevención de APLV, al menos en población de riesgo. Actualmente, en base a la evidencia disponible, no se recomiendan el uso de fórmulas hidrolizadas ni de soja para prevenir el desarrollo de alergia en los niños de alto riesgo.
Actualidad en el manejo de la alergia alimentaria
La opción terapéutica que se podía ofrecer hasta hace unos años en los pacientes con alergia alimentaria era la dieta de exclusión, además de portar los autoinyectores de adrenalina por si presentaban anafilaxia. La evolución habitual para alergia al huevo y la leche es la superación de la misma, hasta el 85% en APLV en los tres primeros años de vida, y hasta el 49,3% en alergia al huevo (AH) en los primeros seis años de vida. Pero existen varios estudios que reportan un incremento de la persistencia de las alergias alimentarias: hasta un 36 % no tolera la leche a los 12 años y hasta un 32 % no tolera el huevo a los 16 años. Además, casi 5 de cada 100 niños alérgicos sufren anafilaxias por exposición accidental al alérgeno. Aunque las muertes por este motivo son raras, permanece estable, estimándose hasta 1,8 muertes/millón de pacientes con alergia alimentaria. Es por estos motivos que nace la necesidad de interferir en la evolución de la alergia, intentando lograr una desensibilización15.
Desde el año 2017 se establece una guía española de inmunoterapia oral (ITO) para leche y huevo, avalado por la SEICAP y la SEAIC. Este procedimiento consiste en incorporar el alimento alergénico en pequeñas cantidades y de forma progresiva. Se persigue conseguir la desensibilización: disminuir el desarrollo de síntomas ante la exposición natural al alergeno, situación que puede ser reversible si la ingesta no es regular y, si es posible, la tolerancia oral permanente del alimento sin síntomas, aunque la ingesta sea irregular16.
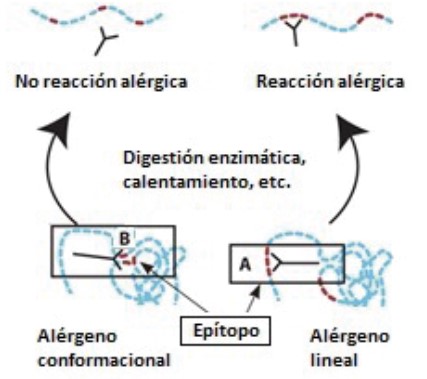
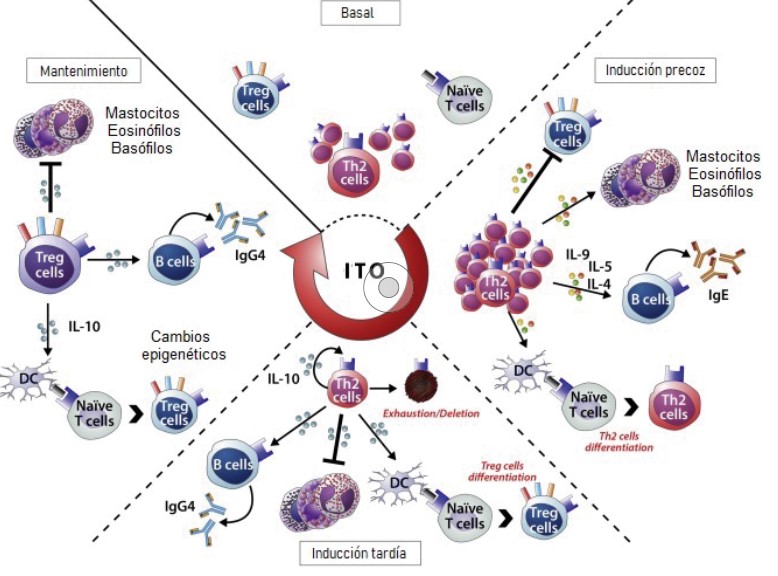
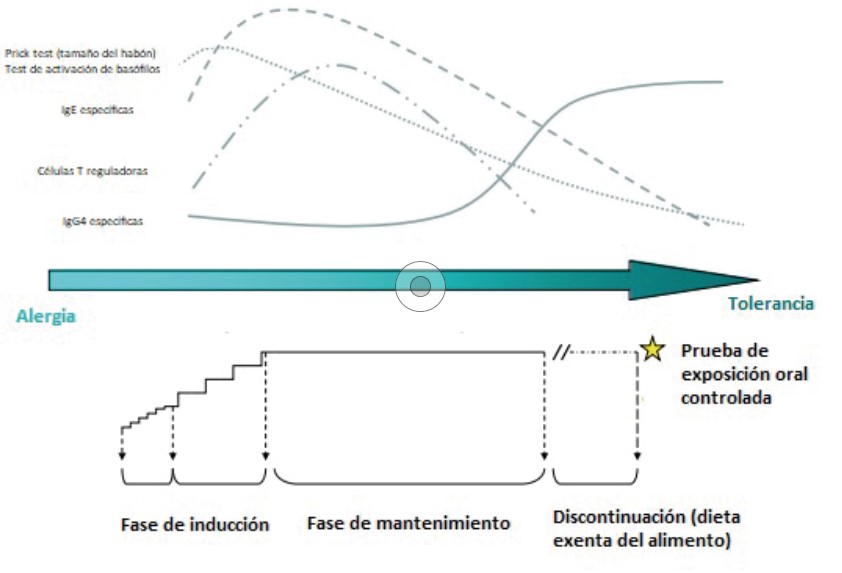
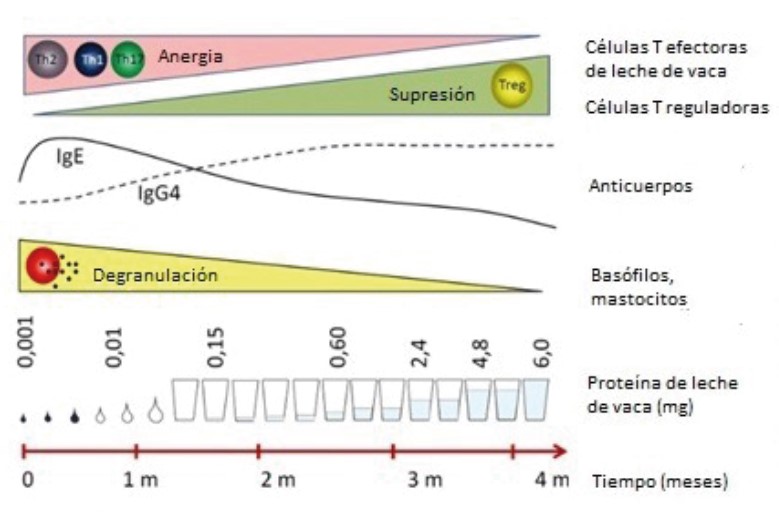
La fisiopatología que explica el desarrollo del procedimiento y sus cambios inmunológicos se resumen en las figuras 2 y 3. Ingerir dosis progresivas del alérgeno genera inicialmente una respuesta IgE, que se traduce en una reacción alérgica, pero esta situación de forma mantenida deriva en la formación de anticuerpos IgG que bloquean a la IgE específica. Con una respuesta clínica manifiesta en que el paciente puede tolerar más cantidad de alérgeno, con menos reacciones alérgicas, y una disminución de la pápula en el prick test. In vitro, se comprueba una disminución progresiva de los valores de IgE específica total del alimento y sus proteínas17-18.
Para la realización de la inmunoterapia es necesario cumplir con unos requisitos. El procedimiento deberá realizarse por facultativo especializado de forma controlada, en un hospital que cuente con Unidad de Cuidados Intensivos Pediátricos. Preferiblemente en un Hospital de día pediátrico, comenzándose en ocasiones con una prueba de exposición oral controlada al alimento que marque el valor umbral. Debe tratarse de pacientes con alergia IgE mediada y se excluirá aquellos con alergia no IgE mediada (esofagitis eosinofílica, enterocolitis inducida por proteínas alimentarias). No podrá realizarse el tratamiento a pacientes con tratamiento inmunosupresor, enfermedad inflamatoria intestinal, mastocitosis o que padezcan enfermedades en los que esté contraindicada el uso de adrenalina, dermatitis atópica severa o asma mal controlado. Se revisarán todos estos aspectos y se firma el consentimiento informado específico del procedimiento, confirmando que los padres se encuentren aptos para realizar el procedimiento, entendiendo las implicaciones que abarca. Se les explica el tratamiento de reacciones y aportamos calendario donde las anotan.
El paciente con mejor evolución es aquel de menor edad, ya que el sistema inmunológico es más maleable. Por el contrario, a mayor edad (y exponencialmente en la adolescencia), si padecen asma, presentan valores elevados de IgE específicas (caseína > 17,5 kU/L y ovomucoide > 8,8 kU/L) y antecedentes de anafilaxia; desarrollan más efectos adversos y de mayor severidad presentando peor evolución y posibilidad de fracaso del tratamiento. En ocasiones no conseguimos la tolerancia permanente pero sí la desensibilización en su mayoría. Es, sin embargo, este perfil de paciente el que más se beneficia de la inmunoterapia por el elevado riesgo de reacción anafiláctica ante contacto accidental con el alérgeno.
Se comienza con diluciones de leche o huevo al 1/10, 1/100 o 1/1000 si es necesario, mediante un protocolo individualizado para cada paciente, con incrementos graduales y progresivos en la fase inicial o fase de inducción. Acuden semanalmente al Hospital de Día, para incremento de dosis y posteriormente los padres administran dosis de mantenimiento en domicilio hasta de nuevo el control hospitalario semanal y así alcanzar dosis diana, que se consigue habitualmente en 4-10 meses. El objetivo es alcanzar una dosis que pueda corresponder a una dieta libre, entendida como 200 ml para leche, o la cantidad de un huevo. Sin embargo, en ocasiones reducimos la dosis (por reacciones graves, intolerancia digestiva o por aversión/ansiedad), manejando cantidad suficiente que proteja contra reacciones accidentales, y se trataría de una desensibilización parcial. La duración de la fase de mantenimiento posterior es dudosa, pero se establece un mínimo de cinco años19.
El principal objetivo del procedimiento es proporcionar seguridad al paciente y a la familia disminuyendo el riesgo de reacciones alérgicas graves. Entre los objetivos secundarios destaca el ampliar la dieta del paciente para mejorar su calidad de vida y la de su familia, ya que la mayoría presenta una gran limitación de diferentes actividades de ocio (excursiones, viajes, restaurantes…) con su impacto social y psicológico asociado. Pese a ello, el mayor inconveniente del procedimiento es la posibilidad de sufrir reacciones alérgicas (91,5 %). Habitualmente son reacciones leves cutáneas, prurito oral, rinoconjuntivitis, síntomas abdominales, etc.; pero existe riesgo de padecer anafilaxia. Se reporta también que hasta el 2,7 % de los pacientes presentan esofagitis eosinofílica.
Revisión de las principales alergias alimentaria en nuestro medio
La alergia a las proteínas de leche de vaca es la alergia más común en la infancia, presentando una frecuencia de 0,5 %-7 % y una prevalencia estimada del 2,5 % (incluyendo alergia IgE y no IgE mediada). La sensibilización ocurre habitualmente en el primer año de vida. La alergia no IgE mediada se resuelve prácticamente el 100 % en el primer año de vida, frente al 57 % de alergia IgE mediada según el estudio de cohortes EuroPrevall20.
La inmunoterapia oral con leche está indicada en los pacientes que mantienen reacción ante la ingesta de leche a partir de 2 años. La fase de inducción consiste en la introducción progresiva de leche de vaca pasteurizada hasta 200 ml de leche si es posible, que corresponden a algo más de 6 gramos de proteínas de leche de vaca (figura 4). En la fase de mantenimiento pueden tolerar derivados lácteos, pero hasta el 26 % de los pacientes, aunque toleran lácteos vacunos, presentan alergia persistente a leche de cabra y oveja a pesar de la elevada homología, con una reactividad cruzada entre dichos mamíferos del 90 %. Es importante considerar que hasta un tercio de los pacientes sometidos a ITO con leche requieren uso de adrenalina21.
La alergia al huevo es la segunda alergia alimentaria en incidencia, estimada en 0,78 % en los primeros dos años, con una prevalencia del 3,2 %. En su tratamiento tenemos disponible la ITO con huevo crudo o cocido. La tendencia actual es introducir huevo horneado, debido a su practicidad, ya que podemos liberar la dieta de trazas de huevo y al ingerir pequeñas cantidades podemos inducir una forma de desensibilización y acelerar la adquisición de tolerancia. El huevo horneado, considerado como cocinado a 180°C durante al menos 20 minutos, reduce la alergenicidad gracias a la matriz de harina por bloqueo al acceso del epítopo. Además, el calentamiento podría destruir los epítopos conformacionales como sucede con la ovoalbúmina (figura 5). Después se introduciría huevo cocido y por último huevo crudo, que es la fuente más alergénica. Se mantendría la dosis de huevo administrada en domicilio y de la forma de cocción en la que se haya introducido, manteniéndolo al menos tres veces por semana. En el caso del huevo, hasta el 20 % de los pacientes con ITO huevo requieren adrenalina.
Nuevas perspectivas en inmunoterapia
La inmunoterapia oral es el método más extendido actualmente por su perfil de efectividad, pero existen diferentes formas de tratamiento en desarrollo: epicutánea, subcutánea y sublingual. Estos medios son, por lo general, menos reactógenos pero también menos inmunogénos. Además, a pesar de que las guías de inmunoterapia se centran en las alergias a la leche y el huevo, se podría realizar a priori con cualquier alimento alergénico. Hay estudios publicados de inmunoterapia oral a trigo, merluza en los alérgicos al pescado, legumbres, frutos secos…
Los estudios han avanzado más con el cacahuete. De hecho, la FDA y la EMA aprobaron en 2020 un medicamento (Palforzia®), para pacientes de 4-17 años, que contiene polvo de cacahuete desgrasado y cuantificado que simplifica la fase de inducción con la ITO cacahuete, consiguiendo tolerar el 50 % un gramo de cacahuete con síntomas leves, frente al 2 % con placebo22.
Dentro de las inmunoterapias sublinguales, destaca la usada frente a la LTP del melocotón (SLIT melocotón®) que está indicada en pacientes con síndrome LTP, con alergia a frutas rosáceas y otras alergias alimentarias por reactividad cruzada, y en ocasiones alergia a pólenes. Todos estos alimentos contienen LTP, por esto es considerado panalérgeno. Ha resultado exitosa para la desensibilización al melocotón, y en algunos pacientes a otros alimentos que contienen LTP, como el cacahuete23,24.
Otra rama de estudio en progreso es la ITO en lactantes, donde no se esperan los tiempos marcados en el protocolo actual sino que se inicia desde su diagnóstico, siguiendo el concepto “alergia diagnosticada, alergia tratada”. Cuentan con resultados muy favorecedores, determinándose como un proceso seguro con una efectividad de desensibilización de hasta el 98%, por lo que podría convertirse en una recomendación universal en el futuro25.
En pacientes de muy alto riesgo o con fracaso de ITO convencional, existe la posibilidad de realizar tratamiento adyuvante con omalizumab. El omalizumab es un anticuerpo monoclonal, humanizado y de origen murino, que se une a la IgE y produce un descenso en los niveles de IgE libre y una disminución de los receptores de alta afinidad para la IgE (FcεRI), provocando una inhibición de la síntesis de IgE específica. De este modo aumenta el umbral de dosis de proteína del alimento con el que reaccionan, disminuye el número y la gravedad de reacciones alérgicas facilitando la ITO con nivel de evidencia I y grado de recomendación A. Los principales inconvenientes asociados son que su precio es elevado, su uso no está probado para este fin y tras suspender el tratamiento, pueden volver a presentar reacciones y sin cambios en la tasa de tolerancia permanente26.
Bibliografía
- Seth D, Poowutikul P, Pansare M, Kamat D. Food Allergy: A Review. Pediatr Ann 2020; 49:e50-e58. doi: 10.3928/19382359-20191206-01
- Dávila IJ, Jáuregui Presa I, Olaguibel-Rivera JM, Zubeldia Ortuño JM. Tratado de Alergología 2ª ed. Madrid: Ergon 2015
- Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, et al; CHILD Study Investigators. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy 2015; 45:632-643
- Stiemsma LT, Reynolds LA, Turvey SE, Finlay BB. The hygiene hypothesis: current perspectives and future therapies. Immunotargets Ther 2015; 27:143-157
- Marrs T, Flohr C. How do Microbiota Influence the Development and Natural History of Eczema and Food Allergy? Pediatr Infect Dis J 2016; 35:1258-1261
- Andrew H Liu. Revisiting the hygiene hypothesis for allergy and asthma. J Allergy Clin Immunol 2015; 136:860-865
- Noster R, Riedel R, Mashreghi MF, Radbruch H, Harms L, Haftmann C, et al. IL-17 and GM-CSF expression are antagonistically regulated by human T helper cells. Sci Transl Med 2014; 6:241-280
- Stein BS, Hrusch CL, Gozdz J, Igartua C, Pivniouk V, Murray SE, et al. Immunity and Asthma Risk in Amish and Hutterite Farm Children. N Engl J Med 2016; 375:411-421
- Nevot-Falcó S, Gómez-Galán C. Prevención de las enfermedades alérgicas. Pediatr Integral 2018; 2:68-75
- Saranz RJ, Lozano A, Bandín G, Andrea I. Mariño AI, Boudet RV, et al. Prevención de las enfermedades alérgicas en la infancia: entre la teoría y la realidad. Arch Argent Pediatr 2016; 114:277-287
- Huang YJ, Marsland BJ, Bunyavanich S, O’Mahony L, Leung DY, Muraro A, Fleisher TA. The microbiome in allergic disease: Current understanding and future opportunities-2017. PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology. J Allergy Clin Immunol 2017; 139:1099-1110. doi: 10.1016/j.jaci.2017.02.007
- Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med 2015; 372:803-813
- Halken S, Muraro A, de Silva D et al. European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol 2021; 32:843-858. doi: 10.1111/pai.13496
- Sakihara T, Otsuji K, Arakaki Y, et al. Randomized trial of early infant formula introduction to prevent cow‘s milk allergy. J Allergy Clin Immunol 2021; 147:224-232.e8. doi: 10.1016/j.jaci.2020.08.021
- Dramburg S, Hilger C, Santos AF et al. EAACI Molecular Allergology User’s Guide 2.0. Pediatr Allergy Immunol 2023; 34 Suppl 28:e13854. doi:10.1111/pai.13854
- Martorell A, Alonso E, Echeverría L, Escudero C, García-Rodríguez R, Blasco C, Bone J, et al; Expert panel selected from members of the Spanish Society of Pediatric Allergology, Asthma and Clinical Immunology (SEICAP) and the Spanish Society of Allergology and Clinical Immunology (SEAIC). Oral Immunotherapy for Food Allergy: A Spanish Guideline. Immunotherapy Egg and Milk Spanish Guide (ITEMS Guide). Part I: Cow milk and egg oral immunotherapy: Introduction, methodology, rationale, current state, indications, contraindications, and oral immunotherapy build-up phase. J Investig Allergol Clin Immunol 2017; 27:225-237. doi: 10.18176/jiaci.0177. PMID: 28731411
- Kulis MD, Patil SU, Wambre E, Vickery BP. Immune mechanisms of oral immunotherapy. J Allergy Clin Immunol 2018; 141:491-498. doi: 10.1016/j.jaci.2017.12.979
- Nowak-Węgrzyn A, Albin S. Oral immunotherapy for food allergy: mechanisms and role in management. Clin Exp Allergy 2015; 45:368-383. doi: 10.1111/cea.12382. PMID: 25077670
- Martorell A, Alonso E, Echeverría L, Escudero C, García-Rodríguez R, Blasco C et al; Expert panel selected from members of the Spanish Society of Pediatric Allergology, Asthma and Clinical Immunology (SEICAP) and the Spanish Society of Allergology and Clinical Immunology (SEAIC). Oral Immunotherapy for Food Allergy: A Spanish Guideline. Egg and Milk Immunotherapy Spanish Guide (ITEMS GUIDE). Part II: Maintenance phase of cow milk (CM) and egg oral immunotherapy (OIT), special treatment dosing schedules. Models of dosing schedules of OIT with CM and egg. J Investig Allergol Clin Immunol 2017; 27:279-290. doi: 10.18176/jiaci.0178
- Schoemaker AA, Sprikkelman AB, Grimshaw KE et al. Incidence and natural history of challenge-proven cow’s milk allergy in European children–EuroPrevall birth cohort. Allergy 2015;70(8):963-972. doi:10.1111/all.12630
- Haahtela T, Alenius H, Lehtimäki J, Sinkkonen A, Fyhrquist N, Hyöty H, Ruokolainen L, Mäkelä MJ. Immunological resilience and biodiversity for prevention of allergic diseases and asthma. Allergy 2021; 76:3613-3626. doi: 10.1111/all.14895
- Patrawala S, Ramsey A, Capucilli P, Tuong LA, Vadamalai K, Mustafa SS. Real-world adoption of FDA-approved peanut oral immunotherapy with palforzia. J Allergy Clin Immunol Pract 2022; 10:1120-1122.e1. doi: 10.1016/j.jaip.2021.12.022
- Gomez F, Bogas G, Gonzalez M, Campo P, Salas M, Diaz-Perales A, Rodriguez MJ, Prieto A, Barber D, Blanca M, Torres MJ, Mayorga C. The clinical and immunological effects of Pru p 3 sublingual immunotherapy on peach and peanut allergy in patients with systemic reactions. Clin Exp Allergy 2017; 47:339-350. doi: 10.1111/cea.12901
- Martin Iglesias MA, Garcia Rodriguez R, Palacios Cañas A, Meneses Sotomayor JV, Clar Castello M, Feo Brito F. Combined LTP Sublingual and Oral Immunotherapy in LTP Syndrome: Efficacy and Safety. J Clin Med 2023; 12:1823. doi: 10.3390/jcm12051823
- Boné Calvo J, Clavero Adell M, Guallar Abadía I, Laliena Aznar S, Sancho Rodríguez ML, Claver Monzón A et al. As soon as possible in IgE-cow’s milk allergy immunotherapy. Eur J Pediatr 2021; 180:291-294. doi: 10.1007/s00431-020-03731-3
- Valdesoiro L, Boné J, Plaza AM. Alergia IgE mediada a proteínas de leche de vaca. Protoc diagn ter pediatr 2019; 2:207-215