Juliors Gonzales Navarro1, Heder Morales Mayorga2, Julian Luna Montalván2, Ernesto Fabre Parrales2, Daniel Acosta Bowen
1 Médico tratante de cirugía pediátrica endoscópica. Hospital de niños Dr. Roberto Gilbert Elizalde. Guayaquil, Ecuador
2 Médicos tratantes de cirugía pediátrica. Hospital de niños Dr. Roberto Gilbert Elizalde. Universidad Católica Santiago de Guayaquil. Guayaquil, Ecuador
Resumen
Se describe el caso clínico de un paciente pediátrico con antecedentes de atresia de esófago con fístula traqueoesofágica tipo III long gap. El manejo terapéutico de la fistula esófago-torácica post-plastia se realizó con E-Vac esofágico.
La esofagostomia cervical se ha utilizado ampliamente para diferir tratamientos en esófago; pueden ocurrir varias complicaciones anastomóticas después de la esofagoplastía. La fuga anastomótica es la complicación más común y grave. Presentamos la alternativa de tratamiento con E-Vac.
Palabras clave: atresia esofágica, E-Vac, esofagoplastía, fuga anastomótica
Therapeutic management of post-plasty thoracic esophageal fistula with E-Vac (endoluminal vacuum therapy) therapy in pediatric patient
Abstract
We describe a case of a pediatric patient whose antecedent is an esophageal atresia with tracheoesophageal fistula type III long gap. The esophago-thoracic fistula was managed post-surgery with an esophageal E-Vac.
Cervical esophagostomy has been widely used to defer esophageal treatment; various anastomotic complications can occur after esophagoplasty. Anastomotic leak is the most common and serious complication. We present the alternative treatment with E-Vac.
Key words: esophageal atresia, E-Vac, esophagoplasty, anastomotic leak
Introducción
La atresia esofágica es una malformación congénita con una frecuencia estimada en un paciente por cada 2.500-4.500 recién nacidos. En gran medida se presenta con fístula traqueoesofágica y eventualmente transcurre de forma aislada. El 25 % se asocia a malformaciones congénitas: cardíacas 35 %, genitourinarias 24 %, gastrointestinales 24 %, esqueléticas 13 % y sistema nervioso central 10 %1.
La esofagostomia cervical se ha utilizado ampliamente para tratar varias enfermedades del esófago incluido el cáncer. Pueden ocurrir complicaciones anastomóticas después de la esofagoplastía. La fuga anastomótica es la complicación más común y grave, su tasa varía del 3 al 25 %2.
La atresia esofágica long-gap es aquella en la que se comprueba una separación entre los cabos mayor de 3 centímetros; por lo general, suelen ser tipo I (atresia sin fístula) y tipo III (atresia con fístula traqueoesofágica distal)1. Estos casos requieren cirugías complejas, que permitan anastomosar los cabos, con el consecuente riesgo de dehiscencia por la tensión ejercida, muchas veces es debido a la calidad del tejido y se convierte en fístula3, que actualmente tiene un manejo conservador que incluye terapia endoscópica (vacío endoluminal E-Vac) mediante uso de una esponja adosada a un dispositivo de succión junto a stents biodegradables, pegamento de fibrina y dispositivos de endosutura4.
La etiología de la perforación esofágica incluye fuga anastomótica posquirúrgica, dilatación post esofágica u otra terapia endoscópica complementaria para tratar las estenosis esofágicas, lesión esofágica traumática secundaria a un cuerpo extraño o impactación de alimentos y síndrome de Boerhaave5.
La terapia de vacío endoluminal conocida como E-Vac, se desarrolló a principios de la década de 1990 6. Es utilizada ampliamente en injertos cutáneos, colgajos, heridas crónicas y quemaduras.
La adaptación de la terapia E-Vac para su uso en fístulas se reportó inicialmente en el 2008. Se caracteriza por mantener succión a presión negativa continua, mediante la colocación de una esponja conectado a un dren sobre una herida. Generalmente la presión manejada es de 100 mmHg3,7. La succión produce efectos primarios y secundarios sobre las heridas. Los efectos primarios son la macrodeformación en donde hay eliminación de líquidos, alteración del entorno de la herida y, por ende, permite un mejor desbridamiento; también interviene la microdeformación que es el cambio mecánico ocurrido a nivel microscópico una vez aplicada la succión7; mediante la succión el material se adhiere firmemente al lecho de la herida dando como resultado el colapso de la cavidad y el lumen intestinal alrededor de la esponja. Estas acciones conducen al depósito de fibrina, neo-epitelización, modulación de la inflamación y el cierre secundario del defecto fistuloso3.
Colocación del E-Vac
El E-Vac se coloca bajo anestesia general con intubación endotraqueal para protección de la vía aérea o con sedación monitorizada. Puede utilizarse un endoscopio estándar con un diámetro de 9 mm o 10 mm dependiendo de la edad, con un canal de instrumentos de 2,8 mm. Se emplea una sonda nasogástrica de 16-18 Fr o un drenaje de Blake acortado. El dispositivo debe modificarse y recortarse para que toda la succión pase a través de la esponja; esto es fundamental en el éxito de la técnica. Se diseña cortando la esponja a un ancho adecuado con un túnel en su centro hasta la punta sin sobrepasar el borde, teniendo cuidado que las fenestras no queden fuera de su longitud, sujetándolas con un monofilamento no absorbible para asegurar la esponja. Seguidamente se introduce el endoscopio hacia la hipofaringe y se coloca el E-Vac en la región de la fístula bajo visión directa cubriendo el defecto. Posteriormente en la remoción del material se utiliza el endoscopio además de maniobras manuales junto a irrigación con solución salina. El recambio del E-Vac varia cada 3-4 días8. Se realiza evitando hemorragias graves y su adhesión al esófago y la herida.
Caso clínico
Presentamos nuestra primera experiencia con E-Vac en el tratamiento de una fístula esófagica post-plastia, en un paciente con antecedentes de atresia esofágica tipo III con long gap.
Paciente masculino con antecedentes prenatales de polihidramnios y postnatales, de atresia de esófago con fístula traqueoesofágica tipo III con long gap, malformación anorrectal, plagiocefalia, cardiopatía congénita septal e hipospadias coronal. Fue intervenido a los dos días de vida mediante toracotomía derecha con cierre de fístula traqueo-esofágica sin éxito. Además, se realizaron una colostomía, una gastrostomía y una esofagostomía.
Al séptimo mes de vida fue valorado en nuestro Centro. La madre manifestó que existía salida de contenido alimenticio por la nariz en el momento de alimentarlo, acompañándose de dificultad respiratoria. Se realizaron exámenes de imágenes con medio de contraste y de laboratorio, una broncoscopia rígida y una endoscopia digestiva alta anterógrada y retrógrada a través de la cavidad oral y por la fistula gastro-cutánea, respectivamente. En la broncoscopia se evidenció una refistulización traqueoesofágica. Los hallazgos endoscópicos en la vía anterógrada fueron la existencia de un cabo proximal del esófago a 10 cm. de longitud desde la arcada dentada y, en la vía retrógrada, una unión esofagogástrica normal con un esófago de buen calibre en condiciones para realizar una plastia.
A los 14 meses de edad se practicó la intervención quirúrgica, realizándose una toracotomía derecha con cierre de fistula traqueoesofágica, esofagoplastía y colocación de un tubo pleural derecho. Al séptimo día de la post-plastia se observó una dehiscencia anastomótica del esófago y la fístula, con salida de un contenido hialino espeso por el tubo del tórax de aproximadamente 200 cc. en 24 horas, por lo que se decidió reintervenir realizándose una nueva esofagoplastía con cierre de la fistula traqueoesofágica, utilizando polifilamento. Al quinto día de la reintervención se apreció la salida de líquido a través del tubo del tórax de 200 cc. en 24 horas de iguales características. Por ello, se colocó una sonda replogle en orofaringe con succión continua, sin resultados favorables. Al décimo tercer día se decidió realizar una endoscopia digestiva alta con colocación de E-Vac, bajo visión directa. Se utilizó una esponja de poliuretano, una sonda de Nelaton 8 Fr, seda, válvula al vacío con llave de tres pasos, plástico adhesivo y succión continua de 200 a 250 mmHg (figuras 1a y 1b).
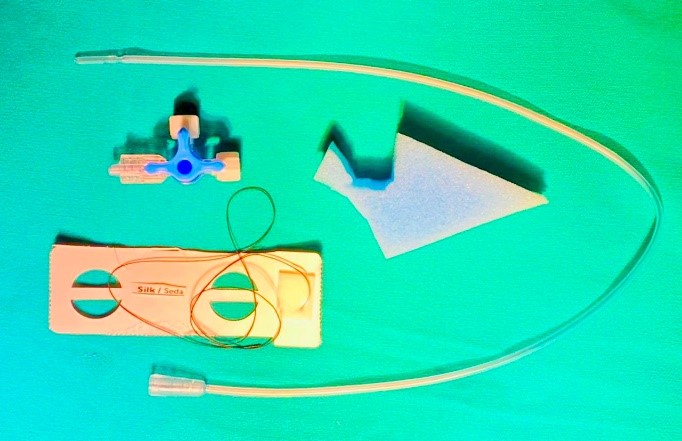
Figura 1a. Materiales que se utilizaron para el diseño del E-Vac (Terapia endoluminal de vacío). Proporcionado por el Dr. Daniel Acosta Farina

Figura 1b. Diseño del E-Vac (Terapia endoluminal de vacío). Materiales: sonda de Nelaton 8Fr, llave de tres pasos, esponja e hilo de sutura seda 2.0. Proporcionado por el Dr. Daniel Acosta Farina
Entre los hallazgos endoscópicos se observaron a nivel de la anastomosis esofágica, una fistula esófago-torácica con un diámetro circunferencial de 5 mm. franqueable al endoscopio (figura 2) y, además, una zona estenótica, fibrosa, no franqueable al endoscopio por lo que se decidió realizar una dilatación con balón neumo-hidrostatico de hasta 6 mm.
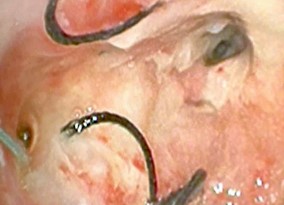
Figura 2. Se observa una fistula esófago torácica
Al cuarto día de la primera endoscopia se observó un trayecto fistuloso esófago-torácico sin resultados, por lo que se colocó el E-Vac sin recubierta plástica. Al tercer día de la segunda endoscopia, se observó la disminución del tamaño de la fistula en un 50% (figura 3).
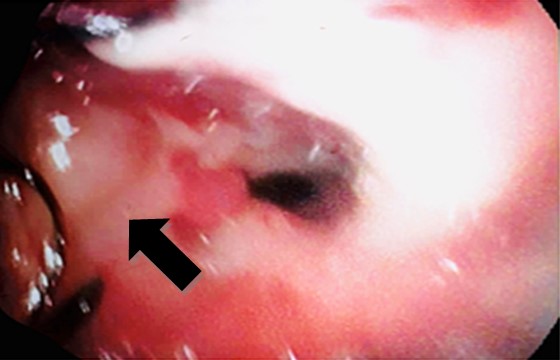
Figura 3. Tejido granulomatoso a nivel de la fistula con un cierre del 50%
Finalmente, se realizó una nueva endoscopia digestiva alta en la que se apreció el cierre completo de la fistula, por lo que se retiró el E-Vac (Figuras 4a y 4b). Al momento, el paciente se encuentra con buena tolerancia oral a los semilíquidos y semisólidos. Permanece en seguimiento por cirugía pediátrica.
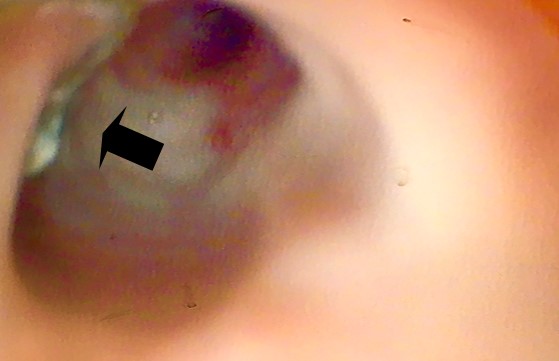
Figura 4a. Cierre al 100% de la fistula esófago torácico
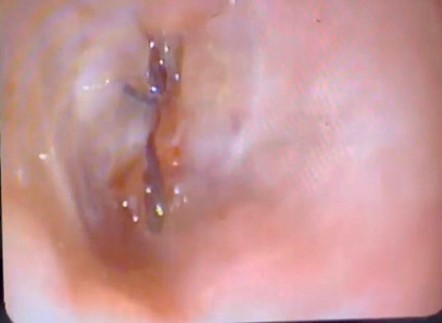
Figura 4b. Área de la plastia esofágica.
Discusión
La fuga esofágica anastomótica o iatrogénica ha sido y sigue siendo un problema que se observa con mucha frecuencia. Su tratamiento se ha convertido en un reto para los cirujanos pediátricos y gastroenterólogos.
El uso de E-Vac se ha descrito en varias comunicaciones de casos retrospectivos. Jung et al. publicaron un estudio de cohorte retrospectivo de treinta y cinco pacientes que utilizaron E-Vac para fugas anastomóticas y perforaciones iatrogénicas, la mayoría de estos pacientes tenían una fuga anastomótica, de los cuales se curaron el 95,2 % de sus pacientes, con una duración media del tratamiento de 11 días, los que tuvieron lesiones iatrogénicas se curaron de la lesión al 100 % con una mediana de tiempo de tratamiento de cinco días, este estudio respalda el uso seguro y eficaz del E-Vac3.
Nuestro caso es comparable a los estudios previos. Hubo éxito con las diferentes dificultades en el método de confección e inserción del E-Vac. El tiempo promedio en el que utilizamos en este paciente el E-Vac fue de diez días con cierre de la fistula.
Manfredi et al. realizaron una revisión retrospectiva de todos sus pacientes que se sometieron a E-Vac para el tratamiento de una perforación esofágica, que abarca desde septiembre de 2014 a diciembre de 2017. También, efectuaron una revisión retrospectiva de todos los pacientes que se sometieron a la colocación de un stent extraíble externamente durante un periodo de ocho años. Los stents utilizados fueron de metal autoexpandibles completamente cubiertos. En ambos estudios realizados se observaron diferencias significativas a favor del E-VAC en las curaciones de perforaciones anastomóticas quirúrgicas5.
Otro estudio de cohorte retrospectivo firmado por Jung et al. demostró la eficacia del E-Vac como parte de un enfoque en donde se pone en consideración muchas técnicas, entre ellas, el uso de clips, stents metálicos auto expandibles y sutura endoscopica, los resultados mostraron una restauración completa del defecto esofágico en el 86 % de sus pacientes, con una duración promedio de aplicación de 12,1 días3.
La complicación por estenosis ocurre en el 7 % de los pacientes8. Jung et al. en un estudio prospectivo que utilizó E-Vac en ocho pacientes portadores de fístula, observaron éxito en el 88 % de las fugas sin complicaciones significativas3.
En conclusión, ponemos en consideración que el uso del E-Vac para el tratamiento de las fistulas anastomóticas e iatrogénicas del esófago deberían ser de primera elección, para evitar riegos de morbi-mortalidad. Este método de tratamiento es bastante prometedor para casos futuros.
Bibliografía
- Barón Ruiz I, Jordán García I, Pociello Almiñana N, Castañón García-Alix M, Palomeque Rico A. Atresia de esófago long-gap: repercusión del momento de la extubación en la evolución. An Pediatr (Barc) 2006; 65:384-385
- Min YW, Kim T, Lee H, Min B-H, Kim HK, Choi YS et al. Endoscopic vacuum therapy for postoperative esophageal leak. BMC Surg 2019; 19:37. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6458610/
- Jung CFM, Müller-Dornieden A, Gaedcke J, Kunsch S, Gromski MA, Biggemann L et al. Impact of endoscopic vacuum therapy with low negative pressure for esophageal perforations and postoperative anastomotic esophageal leaks. DIgestion 2020 Feb 11:1-11
- Wong J, Lal D, Schneider J, Mejaddam A, Manfredi M, Lerner D. Novel placement of an esophageal wound vacuum for a persistent anastomotic leak. Endoscopy 2020 Dec 17. doi: 10.1055/a-1308-1007. Disponible en: https://www.thieme-connect.com/products/ejournals/abstract/10.1055/a-1308-1007
- Manfredi MA, Clark SJ, Staffa SJ, Ngo PD, Smithers CJ, Hamilton TE et al. Endoscopic esophageal vacuum therapy: A novel therapy for esophageal perforations in pediatric patients. J Pediatr Gastroenterol Nutr 2018; 67:706-712
- Goenka MK, Goenka U. Endotherapy of leaks and fistula. World J Gastrointest Endosc 2015; 7:702-713
- Pournaras DJ, Hardwick RH, Safranek PM, Sujendran V, Bennett J, Macaulay GD et al. Endoluminal va cuum therapy (E-Vac): A treatment option in esophagogastric surgery. World J Surg 2018; 42:2507-2511
- Moore CB, Almoghrabi O, Hofstetter W, Veeramachaneni N. Endoluminal wound vac: an evolving role in treatment of esophageal perforation. J Vis Surg 2020; 6:43
