Andrea Martínez Serón, Silvia Molo Amorós, Carlos Trujillo Cabrera, Patricia Silvera Roig
FEA de Unidad Alergología Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil de Canarias
Alergia al veneno de himenópteros
Resumen
Los himenópteros son los insectos que más reacciones alérgicas producen en los niños y su picadura puede llegar a ser una reacción alérgica grave, de instauración rápida y potencialmente mortal.
Tras una picadura la reacción puede ser local, local extensa o sistémica. Es importante identificar los signos y síntomas de anafilaxia para administrar la adrenalina de forma precoz, así como educar a los pacientes en la prevención de picaduras y en el manejo del autoinyector de adrenalina.
El diagnóstico de la alergia al veneno de los himenópteros se basa en una historia clínica sugerente de reacción alérgica y la demostración de IgE especifica frente al veneno del himenóptero sospechoso. Aquellos niños que hayan sufrido reacciones sistémicas han de ser derivados al alergólogo para estudio. En los últimos años se ha desarrollado el diagnóstico por componentes que proporciona un diagnóstico mucho más preciso.
La inmunoterapia específica tiene como objetivo la protección ante una futura picadura y es el único tratamiento que potencialmente puede prevenir las reacciones sistémicas.
Esta revisión describe las características clínicas de la alergia al veneno de himenópteros, así como las recomendaciones basadas en la evidencia para su diagnóstico y tratamiento.
Palabras clave:
alergia, himenópteros, anafilaxia, diagnóstico molecular, inmunoterapia.
Hymenoptera venom allergy
Abstract
Hymenoptera are the insects responsible for the most allergic reactions in children and their sting can generate a fast and severe (even life-threatening) allergic reaction.
The reaction following a sting can be local, local extended or systemic. It is very important to identify the signs and symptoms of anaphylaxis in order to provide an early administration of adrenaline as well as educating patients on the prevention of stings and the use of the adrenaline autoinjector.
Diagnosis of a hymenoptera venom allergy includes a patient history of systemic reaction after an insect sting and detection of a sensitization to hymenoptera venom. Those children who have suffered systemic reactions should be referred to an allergy specialist. Over the last years, component resolved diagnostics have helped to better identify the responsible allergen.
Allergen-specific immunotherapy is intended to protect against a future sting and is the only treatment that can potentially prevent further systemic reactions.
This review describes the characteristics of hymenoptera venom allergy and aims to provide evidence-based recommendations for the diagnosis and treatment of these patients.
Keywords:
allergy, hymenoptera, anaphylaxis, component resolved diagnostics, allergen-specific immunotherapy.
Introducción
Los insectos que más reacciones alérgicas producen en los niños son los himenópteros (abejas y avispas) y sus picaduras son un motivo de consulta frecuente. La picadura por himenópteros puede llegar a ser una reacción alérgica grave, de instauración rápida y potencialmente mortal1.
La prevalencia en Europa de una reacción sistémica tras la picadura de himenópteros en niños es del 0,4-0,8 %2. Se calcula que en la Unión Europea hay alrededor de 200 muertes anuales por picadura de himenópteros. Respecto a España, la prevalencia de reacciones sistémicas tras picadura de himenópteros se sitúa en el 2,3 % de la población general3.
Los himenópteros constituyen uno de los cuatro órdenes de insectos más numerosos, con unas 153.000 HYPERLINK “https://es.wikipedia.org/wiki/Especie” \o “Especie”especies descritas (132 familias, 8423 géneros)4. Dentro del orden de los himenópteros existen dos grandes superfamilias, Apoidea y Vespoidea, conocidas vulgarmente como abejas y avispas. En España las que producen la mayoría de picaduras son la abeja de la miel (Apis mellifera) (figura 1), la avispa común (Vespula sp) (figura 2) y la avispa papelera (Polistes sp (figura 3)2.
Tras una picadura de himenóptero es muy importante identificar el agente responsable. Abeja y avispa son confundidas con frecuencia a primera vista ya que físicamente se asemejan, pero pueden diferenciarse fácilmente si tenemos en cuenta algunos detalles. La principal diferencia entre ambos insectos radica en su tamaño. Así, por lo general, las abejas son bastante más grandes que las avispas. La abeja es más peluda que la avispa. En cuanto al cuerpo, la abeja se caracteriza por presentar un cuerpo peludo, con color pardo y bandas horizontales más claras. Polistes se caracteriza por tener un abdomen con bandas negras y amarillas, que se engruesa progresivamente después de una marcada cintura. En el caso de Vespula, que también presenta un abdomen con bandas negras y amarillas, éste se ensancha rápidamente justo tras la cintura. El aguijón es otro de los elementos diferenciadores entre estos dos insectos. El aguijón de la avispa es liso, se pueden retirar fácilmente y puede picar cuantas veces quiera. Sin embargo, el de la abeja es dentado y está fijo a su cuerpo, de tal forma que una vez pica, este queda incrustado en el cuerpo, se desprende de la abeja y ésta muere4,5.



Manifestaciones clínicas de las picaduras de himenópteros
Reacción local normal. Dolor, prurito, enrojecimiento e inflamación menor de 10 cm en la zona de la picadura que, generalmente, se resuelve en menos de 24 horas. El mecanismo es toxico, debido a los componentes vasoactivos del veneno (histamina, serotonina y catecolaminas).
Reacción local extensa. Presenta síntomas similares a la reacción local normal, pero con una inflamación mayor de diez centímetros de diámetro y duración mayor de 24 horas (puede persistir entre cinco y diez días). Por definición, todos los signos y síntomas aparecen contiguos al sitio de la picadura. Con frecuencia abarca dos articulaciones contiguas, pudiendo llegar a afectar a una extremidad entera. Es un mecanismo mediado por IgE.
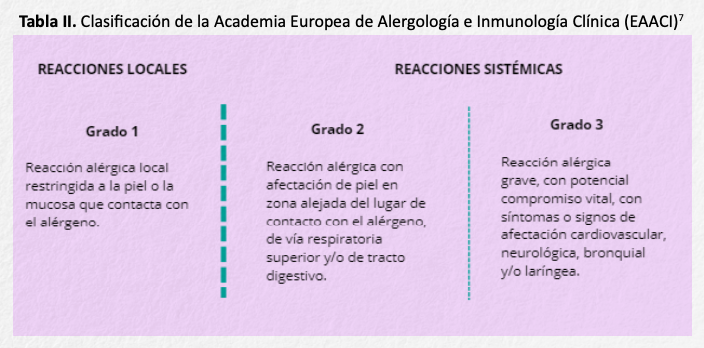
Reacciones sistémicas. Los síntomas cutáneos son los más frecuentes (80 %), generalmente urticaria generalizada que en ocasiones se acompaña de angioedema que puede comprometer la vida si se localiza en cavidad oral o laringe. Las reacciones anafilácticas constituyen la mayor parte de las reacciones sistémicas tras la picadura de himenópteros. Son reacciones alérgicas mediadas por IgE, que producen afectación de uno o más sistemas alejados del lugar de la picadura y suelen aparecer en un periodo corto de tiempo tras esta, desde unos minutos hasta una hora. Los síntomas respiratorios en muchos casos se producen por obstrucción bronquial (sibilancias), por edema laríngeo (estridor y/o disfonía). El edema laríngeo es, probablemente, la principal causa de muerte por picadura de himenópteros. La manifestación cardiovascular más frecuente es la hipotensión, aunque el espectro de síntomas cardiovasculares oscila desde ligero mareo, palpitaciones, disnea o dolor torácico hasta sensación de muerte inminente y choque anafiláctico con hipotensión arterial, pérdida de conocimiento e incontinencia de esfínteres. Alrededor de un tercio de los pacientes presentan síntomas gastrointestinales (vómitos, diarrea, dolor abdominal)5.
Las clasificaciones más utilizadas para valorar la gravedad de las reacciones sistémicas son las de Müller6 y las de la Academia Europea7 (tablas I y II).
Diagnóstico
El diagnóstico de la alergia al veneno de los himenópteros se basa en dos parámetros: una historia clínica sugerente de una reacción alérgica tras una picadura y la demostración de IgE especifica frene al veneno del himenóptero sospechoso8,9.
Historia clínica
Debe recoger los síntomas y la cronología de la reacción. Es importante conocer el tiempo de latencia entre la picadura y el inicio del cuadro, las características e intensidad de los síntomas presentados, así como la existencia de otras enfermedades que puedan incrementar la gravedad de la reacción.

Tipo de reacción.
El dato aislado que mejor predice que sucederá ante una nueva picadura es el tipo de reacción presentada por el paciente con una picadura previa. En general, la diferenciación es sencilla, pero, cuando la picadura ocurre en la cara o en el cuello, puede resultar difícil establecer con seguridad cual ha sido el tipo de reacción desarrollada por el paciente.
Insecto sospechoso. Identificar el agente causal será de gran ayuda para poder interpretar correctamente los resultados de las diferentes técnicas diagnósticas. El paciente debe ser interrogado respecto al lugar donde se encontraba cuando fue picado, las características del entorno, si existían nidos de avispas o colmenas en las cercanías, la presencia de alimentos, agua, etc. La presencia de aguijón en la lesión orienta a favor de una picadura de abeja, pero no es un dato patognomónico.
Para establecer el riesgo de futuras reacciones habrá que tener en cuenta los siguientes factores:
- Grado de exposición a nuevas picaduras: La profesión y costumbres del paciente son de gran importancia. Apicultores, profesiones relacionadas con campo y jardines tiene más riesgo de sufrir nuevas picaduras.
- Gravedad de la reacción previa La intensidad de los síntomas es un dato pronóstico importante; cuanto más grave haya sido la reacción, más probable es que se repita en el futuro.
- Edad Los niños presentan menos probabilidades de desarrollar reacciones ante nuevas picaduras. El riesgo global de presentar una reacción similar es de un 30 % en niños, frente al 70 % de los adultos, incluso 10-20 años después.
- Enfermedades concomitantes El riesgo es mayor cuando el paciente padece enfermedades cardiovasculares o asma y cuando sigue tratamiento con fármacos bloqueantes.
Triptasa basal elevada (> 11,4 μg/L) Unos niveles de triptasa elevados se correlacionan con un riesgo aumentado de reacción grave tras la picadura de un himenóptero10,11. Un nivel elevado de triptasa puede ser un indicador de un síndrome de activación mastocitaria clonal subyacente.
Los síndromes de activación mastocitaria clonal (SAMC-c) incluyen la mastocitosis y otros cuadros que presentan clonalidad mastocitaria demostrada, pero que no llegan a cumplir los criterios de la OMS de mastocitosis sistémica. Se ha demostrado una mayor incidencia de anafilaxia por veneno de himenópteros en pacientes con SAMC-c respecto a la población general. Un grupo bien definido es la mastocitosis sistémica indolente con anafilaxia por veneno de himenópteros. Presenta unas características (demográficas, clínicas y de laboratorio) diferentes a las del resto de mastocitosis. Hay un predominio masculino, el síntoma principal suele ser cardiovascular, con mareo, pre síncope, taquicardia e hipotensión o shock. No suele haber urticaria. La picadura de himenópteros es la primera causa de anafilaxia en estos pacientes.
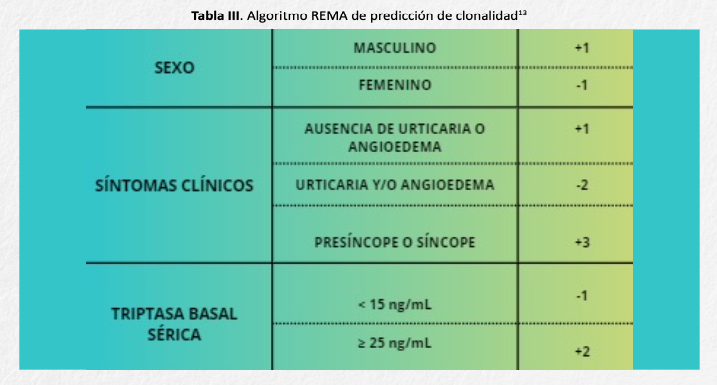
Para identificar a estos pacientes con alta probabilidad de presentar un síndrome de activación mastocitaria clonal (SAMc), se debe aplicar el algoritmo publicado por la Red Española de Mastocitosis (REMA). Una puntuación mayor a 2 indica alta probabilidad de SAMc, por lo que debe realizarse una biopsia de médula ósea o detección de mutación en sangre12,13 (tabla III).
Determinación de IgE específica
Está indicado en pacientes que han sufrido una reacción generalizada con la picadura de un himenóptero y en algunos pacientes con reacciones locales extensas, con alta exposición y/o mala calidad de vida, con vistas a valorar la indicación de inmunoterapia. No está indicado el estudio predictivo en pacientes con miedo a reacciones, o con familiares alérgicos, ya que es frecuente la positividad de pruebas cutáneas y/o IgE especifica en sangre en personas no alérgicas.
Pruebas cutáneas
La prueba cutánea es el test diagnóstico de mayor sensibilidad2. Según las recomendaciones de la Academia Europea su positividad es suficiente para llegar al diagnóstico8. Se realiza mediante prick a 100 μg/ml y en intradermorreacción con 0,02 ml a concentraciones de 0,001, 0,01, 0,1 y 1 μg/ml. La realización simultánea de las pruebas intradérmicas con dos venenos agiliza su realización y ha demostrado ser una práctica segura14.
Una prueba positiva significa sensibilización, pero no predice lo que ocurrirá en las siguientes picaduras y no discrimina entre una reacción local y una generalizada. Hay que saber que toda picadura puede inducir la formación transitoria de IgE específica y que, por tanto, una prueba positiva no es sinónimo de alergia5.
Hasta el 30 % de los pacientes con reacción sistémica tras una picadura presentan pruebas cutáneas negativas. Se recomienda dejar un intervalo de cuatro semanas tras la picadura antes de iniciar el estudio, ya que existe un periodo de anergia en el que pueden darse falsos negativos2.
Son pruebas seguras, aunque en un cuadro de gravedad extrema es recomendable empezar por la prueba intraepidérmica o pueden iniciarse las pruebas ID por una concentración más baja, de 0,0001 μg/ml
Determinación de Ig E frente a veneno total
La presencia de niveles > 0,35 UI/ml indica sensibilización. De forma habitual se solicita IgE específica frente Apis spp., Vespula spp., Polistes dominula y Polistes spp5.
Es menos sensible que las pruebas cutáneas, aunque es positiva en un 5-10 % de los pacientes con pruebas negativas2. Debe considerarse la positividad con valores de IgE específica a partir de 0,1 kUA/L en pacientes con IgE total baja2.
Estudio molecular o por componentes
En los últimos años se ha desarrollado el diagnóstico por componentes que pretende detectar y cuantificar los niveles de anticuerpos IgE específicos para un determinado componente del veneno, proporcionando un diagnóstico mucho más preciso.
El diagnóstico molecular es útil para diferenciar entre la sensibilización primaria a un veneno, cosensibilización a varios venenos de himenópteros, o para diferenciar la presencia de reactividad cruzada en el caso de que varios venenos sean positivos1.
En el caso de la polisensibilización, cuando los pacientes presentan resultados positivos para dos o más venenos es necesario realizar estudio por componentes para una correcta indicación de inmunoterapia específica, al identificar si se trata de una doble (o triple) sensibilización verdadera o, por el contrario, se debe a una reactividad cruzada entre los diferentes venenos15. Hay que tener siempre presente la clínica y no obviar que los pacientes pueden haber presentado reacciones con más de un insecto.
La porción glicosilada de las proteínas del veneno (CCD) es la principal responsable de la doble sensibilización a venenos. El avance del diagnóstico por componentes permite emplear alérgenos recombinantes que expresan epitopos proteicos sin CCD, mejorando la precisión diagnostica16.
El diagnóstico molecular también resulta útil en el caso de resultados negativos ya que nos permitirá detectar IgE específica a alérgenos minoritarios, como por ejemplo Api m 102,17.
La composición del veneno de himénopteros es compleja y se resume en la tabla IV. Para alcanzar un buen rendimiento diagnóstico es imprescindible conocer el papel de cada componente del veneno en particular15-18.
La inhibición de IgE especifica (CAP inhibición) y el test de activación de basófilos se pueden usar, cuando estén disponibles, como técnicas para identificar el sensibilizante primario, aunque tienen sus limitaciones1.
Tratamiento
Medidas de prevención
Se deberá proporcionar una información completa con el fin de reducir el riesgo de una nueva picadura y, en caso de que esta se produzca, saber cómo actuar de forma rápida. Para minimizar el riesgo de exposición existen unas normas que niños y padres deben conocer (tabla V).
Los niños y sus cuidadores deben ser instruidos para reconocer los signos tempranos de anafilaxia y llevar consigo medicación de rescate. Todo paciente con riesgo de anafilaxia debe ser adiestrado en el uso de autoinyector de adrenalina. Éste se presenta en jeringa precargada de 0,15 o 0,30 mg19.
Está indicada la prescripción de adrenalina en pacientes no vacunados que presenten reacciones sistémicas no limitadas a la piel o con reacciones cutáneas generalizadas con alta exposición; en pacientes que reciben ITVH en caso de protección incompleta y en pacientes con síndromes mastocitarios clonales independientemente de si están recibiendo o no ITVH. No está indicada en las reacciones locales20.

Tratamiento de la reacción
Ante una picadura la primera medida es lavar la herida con agua y jabón, aplicar compresas frías o hielo. Si la picadura es de abeja debe retirarse el aguijón lo más rápidamente posible, sin presionar sobre el saco que contiene el veneno porque se podría inocular una mayor cantidad del mismo. Lo importante es retirarlo rápidamente, siendo el método irrelevante
En reacciones locales las medidas tópicas (hielo local, compresas frías…) y la administración de antihistamínicos suelen ser suficientes. Pueden requerirse esteroides tópicos u orales a dosis bajas.
En reacciones sistémicas cutáneas se administran antihistamínicos orales o parenterales y corticoides5,19.
En caso de anafilaxia la rapidez a la hora de administrar el tratamiento adecuado determinará la eficacia del mismo. El tratamiento de elección es la adrenalina 1:1.000 (1 mg/ml) vía intramuscular en la cara externa del muslo a la dosis de 0,01 ml/kg de peso hasta un máximo de 0,5 ml, lo más precozmente posible y traslado a un centro médico para completar el tratamiento según los síntomas que presente el paciente. En segunda línea de tratamiento se encuentran los antihistamínicos de primera generación, que son útiles para el control de la clínica cutánea; y los corticoides, que ayudan a prevenir el desarrollo de reacciones bifásicas o prolongadas5,19,21.
Tratamiento con inmunoterapia específica
Es el tratamiento etiológico y el único tratamiento que modifica la historia natural de la sensibilización alérgica. Los alérgenos son administrados gradualmente, modificándose así la respuesta biológica.
El objetivo del tratamiento es proteger ante una futura picadura ya que es el único tratamiento que potencialmente puede prevenir las reacciones sistémicas1,2,5. Tiene una eficacia de 77 %-84 % en aquellos pacientes tratados con veneno de abeja y de 91 %-96 % en el caso de veneno de véspido22,23.
La inmunoterapia está indicada en pacientes de cualquier edad que hayan sufrido una reacción sistémica, con afectación de varios órganos tras la picadura de un himenóptero y en pacientes con reacción sistémica exclusivamente altamente expuestos (apicultores, profesiones al aire libre.), con morbilidad asociada, difícil acceso a atención sanitaria urgente o en pacientes que tengan mala calidad de vida24. Las contraindicaciones son similares a la inmunoterapia de otros alérgenos, como neoplasias malignas, enfermedades autoinmunes activas o inmunodeficiencias24,25.
No está recomendada en pacientes que no han sufrido reacciones con picaduras ni en aquellos pacientes donde no se puede demostrar una sensibilización (2).
El veneno de las especies Apis mellifera y Vespula está disponible en toda Europa y, además, en España Polistes dominula.
Se ha demostrado que la premedicación con antihistamínicos mejora la tolerancia de la inmunoterapia y no se ve influenciada la efectividad. Se recomienda administrar antihistamínicos 1-2 horas antes de la inmunoterapia24.
La administración de la inmunoterapia ha de hacerse en medio hospitalario y con personal especializado. La pauta de administración consta de dos fases.
Fase de inicio. Desde que se inicia la inmunoterapia hasta que se alcanza la dosis de mantenimiento y existen distintas pautas en función de su duración: ultrarápida (tres horas) o rush (cuatro días) que se reservan para pacientes de alto riesgo; cluster (cuatro semanas) o convencional (tres meses)2,24.
Fase de mantenimiento. Para que la inmunoterapia sea eficaz es necesario llegar a una dosis de mantenimiento de 100 μg del veneno, que equivale al peso seco de dos picaduras de abeja o cinco de avispa. Con estas dosis se llega a una protección del 98 % para véspidos, y del 75-85 % para abeja2,24,25. La eficacia disminuye si se usan dosis de 50 μg24,27. En pacientes que no estén protegidos con dosis de 100 μg (síntomas con repicadura) debe aumentarse la dosis a 200 μg24,28. El mantenimiento se realiza con intervalos mensuales el primer año, cada 6 semanas el segundo y cada ocho semanas del 3º al 5º año. Se recomienda una duración de la inmunoterapia entre tres-cinco años completos, obteniéndose una mejor protección a largo plazo con cinco años24.
En los pacientes con riesgo de recidiva tras la suspensión (mastocitosis o síndromes mastocitarios clonales, pacientes con reacciones graves con la picadura, o que hayan sufrido reacciones a pesar de estar en tratamiento con inmunoterapia) debe mantenerse la inmunoterapia de forma indefinida. Las dosis cada doce semanas han demostrado ser eficaces y seguras2,24.
Se estima que entre el 6-20 % de los pacientes pueden presentar reacciones sistémicas con la inmunoterapia de veneno de himenópteros29,30. El veneno de abeja ha sido descrito la variable independiente más influyente en la aparición de reacciones adversas31,32. Otros factores que se asocian a un mayor riesgo de reacciones adversas son: las pautas de inicio rápidas y ultrarrápidas29,33, la fase de inicio (dosis entre 1-50 μg)29, niveles elevados de triptasa basal (> 11,4 μg/L)12, la presencia de mastocitosis20,34,35.
La eficacia de la inmunoterapia depende de un correcto diagnóstico y de la elección del veneno adecuado, pero a pesar de ello, entre un 5 y un 25 % de pacientes que no están protegidos frente a nuevas picaduras. La inmunoterapia de veneno de abeja se relaciona con un mayor riesgo de fallo de tratamiento que la inmunoterapia con veneno de véspidos2,36-38.
Repicadura
La repicadura controlada con insecto vivo se considera el patrón oro para comprobar la eficacia de la inmunoterapia en aquellos pacientes que no han sufrido una repicadura espontánea. Consiste en observar la reacción que se produce en el paciente la picadura del himenóptero en condiciones controladas. Es una técnica no estandarizada, con una logística complicada y limitada a algunos hospitales2,5,39,40.

El pediatra en atención primaria
Tras una picadura de himenóptero es importante identificar el agente responsable para poder interpretar correctamente los resultados de las diferentes técnicas diagnósticas. El tratamiento de la picadura de himenóptero se tratará en función de la gravedad de la misma. Las reacciones locales se tratarán mediante frío local, antihistamínicos orales y corticoides tópicos o sistémicos. Es importante identificar los signos y síntomas de anafilaxia para administrar la adrenalina de forma precoz, así como educar a los pacientes en la prevención de picaduras y en el manejo del autoinyector de adrenalina. Aquellos niños que hayan sufrido reacciones sistémicas han de ser derivados al alergólogo pediátrico para estudio.
Bibliografía
1. Alfaya Arias T, Soriano Gomis V, Soto Mera T, Vega Castro A, Vega Gutiérrez J, Alonso Llamazares A, et al. Key Issues in Hymenoptera Venom Allergy: An Update. J Investig Allergol Clin Immunol 2017; 27:19-31
2. Sociedad Española de Alergología e Inmunología Clínica. Alergia a himenópteros. Recomendaciones y algoritmos de práctica clínica de la Sociedad Española de Alergología e Inmunología Clínica. 2021. Madrid: Ergon. Disponible en: https://www.seaic. org/wp-content/uploads/2021/05/Alergia_Himenopteros_SEAIC_20_04.pdf
3. Vega Castro A. Epidemiología de la alergia a himenópteros. Madrid: Sociedad Española de Alergología e Inmunología Clínica. Disponible en: https://www.seaic.org/alergia-abejas-y-avispas/sobre-la-alergia/que-es-la-alergia/epidemiologia-de-la-alergia-a-himenopteros
4. Sociedad Entomológica Aragonesa. Revista IDE@. SEA, nº 59 [Citado 30 de junio de 2015]. Disponible en: https://www.sea-entomologia.org
5. Nevot Falcó S, Gómez Galán C, Ferré Ybarz L. Reacciones adversas e hipersensibilidad a venenos de insectos, atrópodos y otros invertebrados. Protoc diagn ter pediatr 2019; 2:341-361
6. Mueller HL. Diagnosis and treatment of insect sensitivity. J Asthma Res. 1966; 3:331-333
7. Muraro A, Fernández-Rivas M, Beyer K, Cardona V, Clark A, Eller E et al. The urgent need for a harmonized severity scoring system for acute allergic reactions. Allergy 2018; 73: 1792-1800
8. Bilo BM, Rueff F, Mosbech H, Bonifazi F, Oude-Elberink JN; the EAACI Interest Group on Insect Venom Hypersensitivity. Diagnosis of Hymenoptera venom allergy. Allergy 2005; 60: 1339-1349
9. Vega Castro A, Antolin Amerigo D, Ruiz Leon B. Diagnóstico y tratamiento de la alergia al
veneno de los himenópteros. Tratado de Alergologia, 2ª Ed. Madrid: Ergon 2016, pp. 1249-
1265
10. Quercia O, Emiliani F, Pecora S, Burastero SE, Stefanini GF. Efficacy, safety, and modulation of immunologic markers by immunotherapy with honeybee venom: comparison of standardized quality depot versus aqueous extract. Allergy Asthma Proc 2006; 27: 151-158
11. Kucharewicz I, Bodzenta-Lukaszyk A, Szymanski W, Mroczko B, Szmitkowski M. Basal serum tryptase level correlates with severity of hymenoptera sting and age. J Investig Allergol Clin Immunol 2007; 17:65-69
12. Gonzalez-de-Olano D, Alvarez-Twose I, Vega A, Orfao A, Escribano L. Venom immunotherapy in patients with mastocytosis and hymenoptera venom anaphylaxis. Immunotherapy 2011; 3:637-651
13. Alvarez-Twose I, Gonzalez-de-Olano D, Sanchez-Munoz L, Matito A, Jara-Acevedo M, Teodosio C, et al. Validation of the REMA score for predicting mast cell clonality and systemic mastocytosis in patients with systemic mast cell activation symptoms. Int Arch Allergy Immunol 2012; 157:275-280
14. Strohmeier B, Aberer W, Bokanovic D, Komericki P, Sturm GJ. Simultaneous intradermal testing with hymenoptera venoms is safe and more efficient than sequential testing. Allergy 2013; 68:542-544
15. Galindo-Bonilla PA, Galán-Nieto A, Alfaya-Arias T, García-Rodríguez C, de la Roca-Pinzon F, Feo-Brito F. Component-resolved diagnosis in vespid venom-allergic individuals. Allergol Immunopathol (Madr) 2015; 4:398-402
16. Blank S, Bilo MB, Ollert M. Component-resolved diagnostics to direct in venom immunotherapy: Important steps towards precision medicine. Clin Exp Allergy 2018; 48: 354-364
17. Jakob T, Rafei-Shamsabadi D, Spillner E, Müller S. Diagnostics in Hymenoptera venom allergy: current concepts and developments with special focus on molecular allergy diagnostics. Allergo J Int 2017; 26:93-105
18. Perez-Riverol A, Sergio Palma M, Jakob T. Current challenges in molecular diagnostics of insect venom allergy. Allergo J Int 2020; 29:79-91
19. Juliá Benito JC, Álvarez Caro F. Anafilaxia en pediatría. Protoc diagn ter pediatr 2019; 2:363-380
20. Stoevesandt J, Sturm GJ, Bonadonna P, Oude Elberink JNG, Trautmann A. Risk factors and indicators of severe systemic insect sting reactions. Allergy 2020; 75:535-545
21. Fundación SEAIC. Guía de actuación en Anafilaxia. Galaxia 2022. Disponible en: https://www.guiagalaxia.com/
22. Muller U, Helbling A, Berchtold E. Immunotherapy with honeybee venom and yellow jacket venom is different regarding efficacy and safety. J Allergy Clin Immunol 1992; 89:529-535.
23. Rueff F, Vos B, Elberink JO, et al. Predictors of clinical effectiveness of Hymenoptera venom immunotherapy. Clin Exp Allergy 2014; 44:736-746
24. Sturm GJ, Varga E, Ree GBPR Van, Spranger DRO. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy 2018; 73:744-764
25. Pitsios C, Demoly P, Bilo MB, et al. Clinical contraindications to allergen immunotherapy: an EAACI position paper. Allergy 2015; 70:897-909
26. Golden DBK. Insect sting allergy and venom immunotherapy: a model and a mystery. J Allergy Clin Immunol 2005; 115:439-747
27. Golden DB, Kagey-Sobotka A, Valentine MD, Lichtenstein LM. Dose dependence of Hymenoptera venom immunotherapy. J Allergy Clin Immunol. 1981; 67:370-374
28. Rueff F, Wenderoth A, Przybilla B. Patients still reacting to a Sting challenge while receiving conventional Hymenoptera venom immunotherapy are protected by increased venom doses. J Allergy Clin Immunol. 2001; 108:1027-1032
29. Mosbech H, Muller U. Side-effects of insect venom immunotherapy: results from an EAACI multicenter study. European Academy of Allergology and Clinical Immunology. Allergy 2000; 55:1005-1010
30. Gutierrez-Fernandez D, Moreno-Ancillo A, Fernandez Melendez S, Dominguez-Noche C, Galvez Ruiz P, Alfaya Arias T. Insect venom immunotherapy: Analysis of the safety and tolerance of 3 buildup protocols frequently used in Spain. J Investig Allergol Clin Immunol 2016; 26:366-373
31. Sturm G, Kranke B, Rudolph C, Aberer W. Rush Hymenoptera venom immunotherapy: a safe and practical protocol for high-risk patients. J Allergy Clin Immunol 2002; 110:928-933
32. Roumana A, Pitsios C, Vartholomaios S, Kompoti E, Kontou-Fili K. The safety of initiating Hymenoptera immunotherapy at 1 microg of venom extract. J Allergy Clin Immunol agosto de 2009; 124:379-381
33. Gorska L, Chelminska M, Kuziemski K, Skrzypski M, Niedoszytko M, Damps-Konstanska I, et al. Analysis of safety, risk factors and pretreatment methods during rush hymenoptera venom immunotherapy. Int Arch Allergy Immunol 2008; 147:241-245
34. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy 2008; 63:226-232
35. Bonadonna P, Gonzalez-de-Olano D, Zanotti R, Riccio A, De Ferrari L, Lombardo C et al. Venom immunotherapy in patients with clonal mast cell disorders: efficacy, safety, and practical considerations. J Allergy Clin Immunol Pract 2013; 1:474-478
36. Rueff F, Wolf H, Schnitker J, Ring J, Przybilla B. Specific immunotherapy in honeybee venom allergy: a comparative study using aqueous and aluminum hydroxide adsorbed preparations. Allergy. junio de 2004; 59:589-595
37. Haeberli G, Bronnimann M, Hunziker T, Muller U. Elevated basal serum tryptase and hymenoptera venom allergy: relation to severity of sting reactions and to safety and efficacy of venom immunotherapy. Clin Exp Allergy 2003; 33:1216-1220
38. Hockenhull J, Elremeli M, Cherry MG, Mahon J, Lai M, Darroch J et al. A systematic review of the clinical effectiveness and cost-effectiveness of Pharmalgen® for the treatment of bee and wasp venom allergy. Health Technol Assess 2012; 16: III-IV, 1-110
39. Goldberg A, Confino-Cohen R. Bee venom immunotherapy – how early is it effective? Allergy 2010; 65:391-395
40. Rueff F, Przybilla B, Bilo MB, Muller U, Scheipl F, Seitz MJ, et al. Clinical effectiveness of hymenoptera venom immunotherapy: a prospective observational multicenter study of the European academy of allergology and clinical immunology interest group on insect venom hypersensitivity. PLoS One 2013; 8:e63233
