Carol Prieto Morín
F.E.A. Análisis Clínicos. Unidad de Genética. CHUNSC. Santa Cruz de Tenerife.
Introducción
Los avances científicos y tecnológicos en el campo de la genética en los últimos 20 años han revolucionado la práctica totalidad de las áreas de la medicina. Incluso clasificaciones de enfermedades basadas en la clínica han dado paso a clasificaciones desde el punto de vista genético, gracias a la creciente evidencia sobre las bases moleculares de la patología humana. El progreso tecnológico y la rápida implementación de las técnicas de secuenciación masiva, han favorecido que en la actualidad la tecnología se sitúe por delante del conocimiento científico. El desarrollo tecnológico ha ido de la mano del desarrollo bioinformático, herramienta fundamental para el manejo de la gran cantidad de datos generados por este tipo de estudios. En el campo del diagnóstico genético, en un espacio vertiginosamente pequeño de tiempo, hemos pasado de disponer de herramientas para el estudio dirigido de unas pocas patologías, a tener la capacidad técnica para estudiar el genoma completo del paciente a estudio. Sin embargo existe aún una brecha importante entre la gran capacidad actual de obtener información genética extensa y la capacidad de ofrecer intervenciones clínicas definitivas basadas en el conocimiento adquirido, motivo por el cual no todas las técnicas desarrolladas son de uso en la práctica clínica.
Se conocen más de 20.687 genes codificantes para al menos un producto proteico, lo que representa aproximadamente el 1,5% del ADN en el genoma humano. Aunque más del 98% del genoma no codifica para proteínas, el proyecto ENCODE1,2 puso de manifiesto la importancia funcional del genoma no codificante (al que anteriormente se le conocía como ADN basura) ya que se estimó que el 80.4% del genoma participa en al menos un proceso regulador, abriendo la puerta al estudio del genoma completo para buscar la causa de enfermedades de base genética desconocida. Es fundamental para el Pediatra reconocer las enfermedades de base genética más frecuentes, sus implicaciones y los estudios genéticos disponibles para diagnosticarlas correctamente y que esto se traduzca en la mejor atención posible al paciente. Esto requiere de una actualización permanente del especialista en Pediatría, sobre todo teniendo en cuenta el potencial beneficio de la terapia génica, como ocurre en el caso de la atrofia muscular espinal, o la distrofia muscular de Duchenne, donde el reconocimiento temprano de la patología y la rápida instauración del tratamiento modifican enormemente en curso de la enfermedad.
El objetivo de este documento es describir brevemente las principales técnicas de diagnóstico genético utilizadas en la práctica clínica habitual, su aplicación a los distintos tipos de enfermedades genéticas abordables desde la edad pediátrica, los posibles resultados que pueden obtenerse en este tipo de estudios (teniendo en cuenta la posibilidad de identificación de variantes de significado clínico incierto y hallazgos incidentales) y los aspectos a considerar al solicitar este tipo de pruebas, como el pertinente asesoramiento genético a los padres o tutores y la firma del preceptivo consentimiento informado.
Abordaje de las enfermedades de causa genética
Actualmente se conocen 16.752 genes listados en OMIM (Online Mendelian inheritance of Man) cuya herencia es mendetes para al menos un producto proteico, lo que representa aproximadamente el 1,5% del ADN en el genoma humano. Aunque más del 98% del genoma no codifica para proteínas, el proyecto ENCODE1,2 puso de manifiesto la importancia funcional del genoma no codificante (al que anteriormente se le conocía como ADN basura) ya que se estimó que el 80.4% del genoma participa en al menos un proceso regulador, abriendo la puerta al estudio del genoma completo para buscar la causa de enferliana o mitocondrial. Se han descrito 6.402 fenotipos clínicos con base molecular conocida (que pueden estar relacionados con más de un locus). Estas enfermedades pueden tener un patrón de herencia recesivo, dominante, ligado al sexo o de herencia mitocondrial. Aunque la mayoría de estas patologías son consideradas raras de forma individual (prevalencia es inferior a 5 casos por cada 10.000 personas), en su conjunto afectan al 7% de la población mundial, según datos de la Organización Mundial de la Salud, y en la mayoría de los casos se manifiestan en la edad pediátrica. Por otra parte, según el informe de la Organización Europea de Enfermedades Raras, el 80% de las enfermedades raras son de origen genético5.
Los estudios genéticos pueden tener varias finalidades: las más conocidas son la diagnóstica y terapéutica, ésta última cada vez más relevante debido a los últimos tratamientos dirigidos a dianas moleculares, como en el caso de la fibrosis quística o la distrofia muscular de Duchenne. Sin embargo existen otros contextos igualmente relevantes, como la finalidad pronóstica (no disponible en todos los casos) pero que puede repercutir en un seguimiento clínico más adecuado a la patología, el estudio presintomático en individuos pertenecientes a familias en las que una alteración genética ha sido identificada y el estudio de portadores de cara a planificación familiar. En los estudios prenatales, el resultado puede conducir a la decisión de interrupción médica del embarazo (IME) cuando se identifican alteraciones incompatibles con la vida o con un mal pronóstico vital. No menos importantes son los estudios farmacogenéticos, claves en la terapia personalizada y que permiten una individualización terapéutica de fármacos potencialmente tóxicos, evitando reacciones adversas graves y fracasos terapéuticos. Otro aspecto a considerar es que los estudios genéticos son susceptibles de realizarse en todas las etapas de la vida: en el contexto preconcepcional, preimplantacional, en la etapa prenatal, postnatal y postmortem (figura 1).
Herramientas diagnósticas
Las herramientas diagnósticas usadas en genética pediátrica son diversas en escala, potencia diagnóstica, resolución y tiempo de respuesta. El avance tecnológico anteriormente citado y el abaratamiento de los costes, ha permitido que estos estudios sean accesible desde el ámbito asistencial y de la investigación. Hay que tener presente que no existe una prueba de diagnóstico molecular universal. Incluso la herramienta más potente de la que disponemos en la práctica clínica asistencial, el exoma, no detectará alteraciones de la impronta, grandes deleciones o duplicaciones ni tampoco mutaciones por expansión, aunque es de esperar que en un futuro no lejano se desarrollen nuevas herramientas que solventen las limitaciones actuales. Por tanto, es crucial el reconocimiento de los fenotipos clínicos para la elección de la prueba genética más adecuada. La elección de una prueba inadecuada puede conllevar un error diagnóstico (falso negativo) y la falsa impresión de ausencia de enfermedad transmisible. El conocimiento del tipo de alteración causante de la enfermedad a estudio determinará la técnica diagnóstica a elegir y por tanto las probabilidades de éxito de la misma (tabla 1).
1. Técnicas de citogenética clásica:
Las técnicas de citogenética clásica analizan cromosomas completos o fragmentos largos de ADN. Son capaces de detectar la ganancia o pérdida de material genético, ya sea de cromosomas enteros (trisomía o monosomía, respectivamente), o de segmentos cromosómicos así como reordenamientos de segmentos cromosómicos (traslocaciones).
1-1 Cariotipo: El cariotipo es el conjunto completo de los cromosomas de un individuo. El término también se refiere a la imagen producida en el laboratorio de los cromosomas en metafase aislados de una célula individual y dispuestos en orden numérico. El cariotipo tiene como finalidad identificar anomalías numéricas o estructurales de los cromosomas. Al analizar numerosas células de manera individual, el cariotipo permite detectar la presencia de mosaicismos. También, permite detectar inversiones y traslocaciones balanceadas (sin pérdida ni ganancia de material genético), siempre que se encuentren dentro del límite de resolución (5-10 Mb). Una de sus aplicaciones más conocidas ha sido el diagnóstico prenatal de alteraciones cromosómicas, causantes de diferentes trastornos genéticos como el Síndrome de Down o el Síndrome de Edwards. Dado que es necesario realizar un cultivo celular, el tiempo de respuesta es largo (3 semanas aproximadamente), por lo que en paralelo se utilizan técnicas moleculares con un tiempo de respuesta menor (24-48 h) para el screening de aneuploidías más frecuentes durante el embarazo, como la QF-PCR (Quantitative Fluorescent Polymerase Chain Reaction). Sin embargo hay ocasiones en las que la QF-PCR no es interpretable por la presencia de contaminación materna de la muestra prenatal o cuando la insuficiente celularidad de la muestra hace necesario el cultivo celular. Otras aplicaciones importantes del cariotipo es en el estudio de infertilidad y en el diagnóstico/ pronóstico/seguimiento de hemopatías malignas6,7.
1-2 FISH (Fluorescent in situ hybridization): Esta técnica se basa en la utilización de sondas con marcaje fluorescente que hibridan por complementariedad a la región genómica de interés. Esta hibridación se produce mientras la célula está en metafase (sobre una preparación para cariotipo) o sobre interfase (células en fresco sin necesidad de cultivo previo). Mediante esta técnica es posible detectar duplicaciones o deleciones genómicas, inversiones, traslocaciones balanceadas, así como mosaicismos. Sin embargo es necesario tener una sospecha diagnóstica para utilizar las sondas FISH específicas del locus o loci relacionadas con la patología en estudio.
2. Técnicas de citogenética molecular: Array CGH
La técnica del array CGH (Comparative Genomic Hybridization) se basa en la hibridación conjunta del ADN del paciente y un ADN control, marcados con diferentes fluorocromos, a un soporte sólido que contiene fragmentos de ADN previamente inmovilizados (sondas). El ADN del paciente compite por el ADN control en su unión a las sondas, de manera que la fluorescencia de cada posición dependerá de la proporción de ADN del paciente con respecto al control y permitirá identificar ganancias o pérdidas de material genético. La resolución depende de la densidad de sondas y la distancia que existe entre ellas, así como del tamaño de las mismas. Cuanto más pequeño sea el fragmento de ADN utilizado como sonda y más cerca se encuentren cada dos sondas consecutivas, mayor será la resolución: así el array CGH 60K tiene 60.000, el 180K tiene 180.000 sondas distribuidas por todo el genoma, etc. Generalmente la distribución de las sondas no es uniforme y hay zonas del genoma relacionadas con patologías conocidas que tienen mayor densidad de sondas, y en consecuencia es posible detectar alteraciones de menor tamaño. Esta técnica tiene una mayor sensibilidad y poder de resolución respecto al cariotipo para detectar CNV (Copy Number Variations, o alteraciones en el número de copia: deleciones, duplicaciones o reordenamientos desbalanceados). Sin embargo el array CGH no detecta alteraciones cromosómicas balanceadas (inversiones o traslocaciones), reordenamientos en regiones no cubiertas por las sondas, disomías uniparentales, variaciones en regiones repetitivas, como las expansiones de tripletes, ni mosaicismos de bajo grado (cuando la alteración está en un porcentaje inferior al 20-30% en las células desde las que se obtuvo el ADN)7 (Figura 2, en página siguiente).
3. Técnicas de genética molecular
Las técnicas de genética molecular se centran en buscar cambios en la secuencia del ADN, por lo que se conocen también como técnicas de secuenciación. La mayoría tienen como finalidad identificar variantes de tipo puntual, es decir cambios de un único nucleótido (SNV: single nucleotide variants) y pequeñas inserciones o deleciones. Si los cambios se producen en genes codificantes para proteínas, estos cambios pueden repercutir en la proteína resultante y dar lugar a una patología.
3-1 Secuenciación capilar o secuenciación Sanger: esta herramienta desarrollada en 1977 supuso un gran avance que ayudó a descifrar la secuencia del genoma humano, sin embargo, aunque se ha automatizado, sigue requiriendo mucho tiempo y su precio con relación a otras técnicas de secuenciación es elevado. Actualmente se utiliza para estudiar variantes familiares o recurrentes o para estudiar genes de pequeño tamaño cuando la sospecha clínica está muy definida, como por ejemplo la beta-talasemia.
3-2 Secuenciación masiva: el desarrollo de las técnicas de secuenciación masiva, también conocidas como secuenciación de nueva generación o Next Generation Sequencing (NGS) ha permitido el desarrollo de la genética en las últimas décadas, el abaratamiento de los costes de secuenciación y el acceso a los estudios genéticos a gran escala a los centros públicos asistenciales. Para hacernos una idea, la secuenciación del genoma humano (Proyecto Genoma Humano) tardó una década y tuvo un coste de 2.700 millones de dólares para obtener la secuencia de las 3.200 millones de pares de bases que constituyen el genoma. Hoy en día es posible secuenciar un genoma por un precio aproximado de 1000 euros y obtener los resultados en días. La extensión del estudio que hagamos dependerá de la sospecha diagnóstica. Si esta es muy clara y se relaciona con una patología relacionada asociada a un único gen, este estudio se podrá abordar mediante secuenciación sanger (si el gen es pequeño, como se comentó anteriormente) o mediante secuenciación masiva (para genes grandes como el NF1, relacionado con la neurofibromatosis tipo 1).
3-2-1 Paneles de genes: existen kits comerciales específicos para grupos de genes relacionados con enfermedades asociadas a muchos genes (heterogeneidad de locus) como las cardiopatías hereditarias. Tienen como ventaja que los genes que estudian están muy bien cubiertos y en ocasiones permiten hacer el estudio de CNVs tras el correspondiente análisis bioinformático.
3-2-2 Exoma clínico: esta técnica consiste en secuenciar los aproximadamente 6000 genes actualmente asociados a fenotipos clínicos. En muchas ocasiones cuando el fenotipo no está bien definido, este es el estudio de elección. Incluso cada vez se está optando más por realizar el exoma clínico y usar paneles virtuales (filtrado bioinformático de los genes relacionados con una determinada patología) en detrimento de los paneles clásicos de genes, ya que haciendo uso de los paneles virtuales tendríamos la posibilidad de revaluar los datos genéticos en el futuro. Este aspecto es particularmente importante en pediatría, donde podemos estudiar a niños que aún no han desarrollado todo el espectro fenotípico de la enfermedad que padecen. El exoma clínico es una de las herramientas más usadas actualmente en las unidades de genética asistencial.
3-2-3 Exoma completo (Whole Exome Sequencing: WES) y genoma completo (Whole Genome Sequencing: WGS): consiste en estudiar los 20.000 genes codificantes (1.5% del genoma) o el genoma completo, respectivamente. Este tipo de estudios no se emplean habitualmente en la rutina asistencial. Se recurre a ellos en contexto de investigación en pacientes con fenotipos complejos en los que los estudios genéticos previos no son concluyentes (normalmente se ha realizado previamente un cariotipo, un array y un exoma clínico).
3-3 MLPA y MS-MLPA: la técnica MLPA (Multiplex Ligation-dependent Probe Amplification) permite detectar CNVs de hasta 40 o 50 loci de manera simultánea. Existe una modificación de la técnica de MLPA, “la MSMLPA”(methylationspecific MLPA), con la que se pueden estudiar también cambios en el estado de metilación del ADN, relacionados con patologías por impronta. En este caso se pueden detectar en un mismo ensayo CNVs y estado de metilación de manera simultánea en varias regiones, y permite cuantificar y en parte discriminar entre la metilación de ninguno, uno o los dos alelos. El MS-MLPA es una prueba de gran utilidad para el estudio de enfermedades causadas por errores de impronta (no detectables por otras técnicas moleculares), como los síndromes de Prader-Willi y Angelman (figura 3).
Tipos de variantes
Los estudios genéticos de secuenciación y de análisis de CNVs pueden identificar variantes de distintas connotaciones clínicas. En la práctica clínica, el objetivo principal del diagnóstico genético es determinar si el paciente a estudio tiene una variante patogénica o probablemente patogénica (para patologías de herencia dominante) que confirme la sospecha diagnóstica, y que a su vez pudiera tener repercusiones para padres y otros familiares. Para patologías de herencia recesiva, sería necesario la identificación la variante en homocigosis o de dos variantes en heterocigosis compuesta. El proceso de valoración de la evidencia científica disponible sobre las variantes genéticas y su posible impacto y causalidad con respecto a la patología por la cual es referido el paciente, se denomina interpretación de variantes. La interpretación de variantes requiere una formación específica y eminentemente práctica. En 2015, el Colegio Americano de Genética Médica y Genómica publicó una guía para la clasificación de las variantes. Su utilización es prácticamente universal en los laboratorios de genética asistencial8. Las categorías en las que se clasifican las variantes son las siguientes:
- Variante patogénica: la variante identificada se considera la causa de la enfermedad del pacient En este caso la variante está bien establecida como causante de enfermedad en las bases de datos y la literatura científica, y existe un amplio consenso sobre la patogenicidad de la variante. La identificación de una variante patogénica confirma el diagnóstico de sospecha y permite el estudio de familiares, el asesoramiento genético sobre el riesgo de recurrencia de la enfermedad en la familia y las técnicas de diagnóstico genético preimplantacional y prenatal.
- Variante probablemente patogénica: la variante identificada se considera la causa probable de la enfermedad del pacient Para estas variantes se cumple que existe una clara correlación genotipofenotipo. En estos casos es fundamental tener una minuciosa información sobre el fenotipo del paciente y los antecedentes familiares. En la práctica, las implicaciones de las variantes probablemente patogénicas son, en la mayoría de los casos, las mismas que las de una variante patogénica: se recomienda asesoramiento genético y estudio familiar.
- Variante de Significado Incierto: la variante está en un gen relacionado con la patología del paciente, pero la información científica en el momento de la interpretación es insuficiente o contradict Suele ser el caso de variantes ausentes o con una frecuencia alélica muy baja en las bases de datos poblacionales, en un gen asociado al fenotipo del paciente estudiado. En estos casos, el manejo del paciente y su familia debe basarse en la clínica y los antecedentes familiares, y la variante no debe usarse en estudios familiares en el contexto asistencial. En ocasiones, si se dispone de familiasinformativas (en la que existen numerosos miembros afectos y no afectos de la patología a estudio) se puede hacer un estudio de segregación de la variante con el objetivo de aportar elementos adicionales para la revaloración de la variante y eventualmente, reclasificarla como probablemente patogénica o probablemente benigna.
- Variante probablemente benigna: es poco probable que la variante sea la causa de la enf Suele ser el caso de variantes frecuentes en las bases de datos poblacionales con respecto a la prevalencia y la penetrancia de la enfermedad en estudio. Se considera negativo o no concluyente un estudio genético en el que únicamente se identifiquen variantes probablemente benignas.
- Variante benigna: la variante no se considera la causa de la enfermedad es El estudio es también considerado como negativo o no concluyente9.
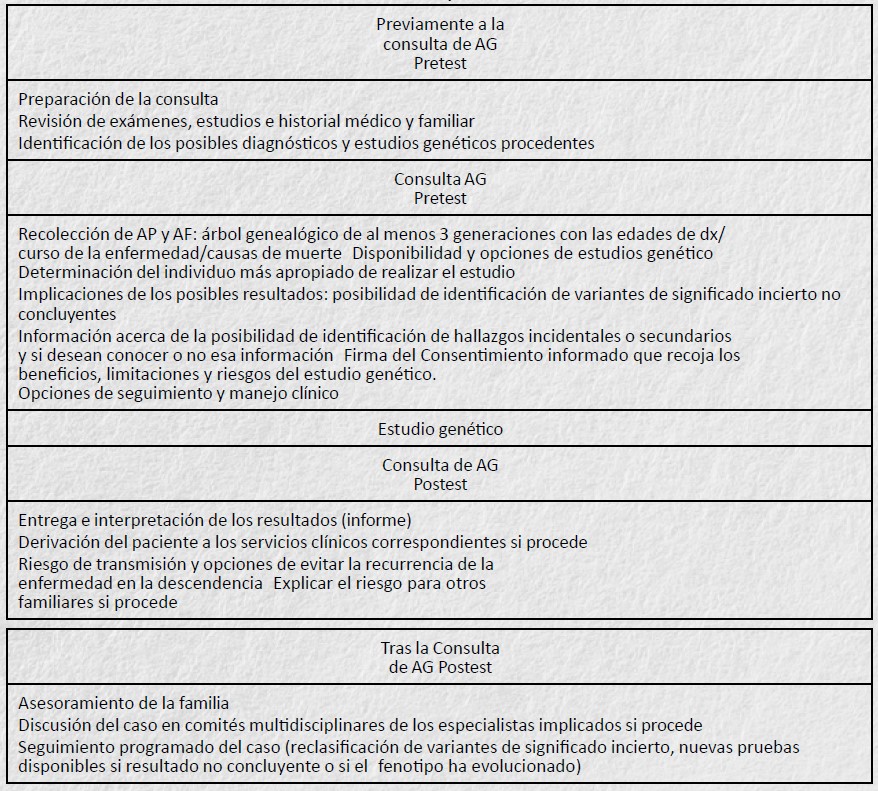
Asesoramiento genético y consentimiento informado
El asesoramiento genético (AG) se define como el proceso por el que pacientes o familiares con riesgo de padecer una anomalía o enfermedad hereditaria son asesorados sobre sus consecuencias, sobre la probabilidad de desarrollarla o transmitirla, y sobre la forma en que esta se puede prevenir, evitar o mejorar10. El AG es imprescindible antes (AG pretest) y después (AG postest) de cualquier prueba genética que se vaya a realizar, incluso tiene lugar en casos en los que no se llega a efectuar el estudio genético, ya que habiendo explicado el estudio, sus ventajas, limitaciones e implicaciones, el paciente puede decidir no realizar el test genético. Así queda reflejado en el artículo 55 de la Ley de Investigación biomédica 14/2007:
- “Cuando se lleve a cabo un análisis genético con fines sanitarios será preciso garantizar al interesado un asesoramiento genético apropiado, en la forma en que reglamentariamente se determine, respetando en todo caso el criterio de la persona interesada”.
- “El profesional que realice o coordine el consejo genético deberá ofrecer una información y un asesoramiento adecuados, relativos tanto a la trascendencia del diagnóstico genético resultante, como a las posibles alternativas por las que podrá optar el sujeto a la vista de aquél”
El proceso del AG pretest culmina con la firma del consentimiento informado (CI), que representa la manifestación de la voluntad libre, consciente y válidamente emitida por una persona capaz, o por su representante autorizado, precedida de la información adecuada (Ley de Investigación Biomédica).
En los casos de menores o pacientes no competentes el CI es otorgado por terceros: sus padres o tutores. En el caso de los menores, existe una maduración progresiva de forma que su capacidad de comprensión y de decisión autónoma va aumentando progresivamente. A medida que se va haciendo capaz de entender, hay que darle la información adecuada que pueda comprender y obtener su asentimiento. En general, se consideran tres rangos de edad: niños menores de 7 años (el CI lo dan padres o tutores), de 7-12 años (se les debe dar una explicación suficiente para que entiendan el estudio) y mayores de 12 años. Estos últimos (cuando se considera que son suficientemente maduros pueden opinar antes) deben firmar el CI, si no tienen objeción a lo que se les ha propuesto, después de proporcionarles información comprensible. En el documento de CI se les indica que, al llegar a la mayoría de edad (si entonces son competentes), pueden ejercer su derecho de revocación (de hecho, pueden ejercerlo antes), pero si no lo ejercen, se considerará válido el CI vigente11.
La citada ley no especifica qué profesionales deben proveer el asesoramiento genético; se menciona que deben ser profesionales adecuadamente formados, lo cual deja la responsabilidad de formarse adecuadamente al profesional susceptible de solicitar estudios genéticos. (Tabla 2)
Existen particularidades del AG que nacen a partir de la introducción del los estudios de exomas clínicos, así como el WES y el WGS: los hallazgos incidentales y secundarios:
- Hallazgos incidentales (también llamados inesperados o no solicitados): son hallazgos adicionales que pueden tener implicaciones potenciales para la salud del paciente y su familia, pero que no están relacionados con la enfermedad que motivó el estudio genétic Un ejemplo sería la identificación de una variante patogénica en un gen relacionado con miocardiopatía hipertrófica en un estudio de exoma dirigido a epilepsia.
- Hallazgos secundarios: se trata de hallazgos intencionalmente buscados y secundarios al objetivo que motivó el es
El AG pretest debe contemplar la información al paciente o sus padres sobre esta posibilidad y recoger si desean o no ser informados de los mismos. El Colegio Americano de Genética Médica y Genómica publicó en 2013 la primera guía para el manejo de hallazgos incidentales, la cual ha sido actualizada recientemente12.
Desafíos en el diagnóstico de enfermedades genéticas en pacientes pediátricos
Una proporción muy importante de las enfermedades raras afecta a la población pediátrica. Las condiciones genéticas y las malformaciones son las principales causas de muerte infantil en las unidades de cuidados intensivos neonatales. Las enfermedades raras son generalmente multisistémicas y de naturaleza compleja, y debido a su rareza, estos trastornos generalmente no son identificados como casos familiares/ genéticos. Puede darse la circunstancia de que la ausencia de antecedentes familiares, debido a la ocurrencia de mutaciones de novo o mosaicismos en los progenitores, dificulte el reconocimiento de una patología como hereditaria. La identificación de patologías genéticas en este entorno es excepcionalmente desafiante para una serie de razones: en primer lugar hay que destacar la presentación clínica con expresividad variable, penetrancia incompleta, coocurrencia de modificadores genéticos y factores ambientales, y la heterogeneidad genética (común a una parte importante de estos trastornos) que pueden complicar aún más la capacidad de obtener un diagnóstico específico. En el momento de la anamnesis del paciente pediátrico, es posible que no se haya expresado el fenotipo completo y los signos clínicos pueden verse agravados por factores tales como la prematuridad. Estas circunstancias pueden conducir a la inadecuada elección de la técnica diagnóstica o de los genes candidatos a estudio y suponer el fracaso del estudio, con el consecuente retraso del diagnóstico del paciente13.
Conclusiones
- El diagnóstico genético constituye una herramienta indispensable en las enfermedades de causa genética, que afectan al 7% de la población a nivel mundial.
- Los estudios genéticos son diversos en utilidad, rendimiento y limitaciones diagnósticas, y el éxito de los mismos depende de su adecuada elección.
- El Asesoramiento Genético antes y después de cada estudio es obligatorio para que el paciente (cuando proceda) y sus padres puedan tomar la decisión más adecuada en función de su situación personal y familiar.
- Se recomienda un abordaje multidisciplinar de las patologías hereditarias para optimizar el proceso
- diagnóstico y el manejo de los pacientes y sus familias.
Bibliografía
- Dunham, Kundaje, A. Aldred, S. F. Collins, P. J. Davis, C. A. Doyle, F. Epstein, C. B. Frietze, S.Harrow, J. Kaul, R. et al. (2012). An integrated encyclopedia of DNA elements in the human genome. Nature 489, 57-74.
- Ecker, J. R., Bickmore, W. A., Barroso, , Pritchard, J. K., Gilad, Y. and Segal, E. (2012). Genomics: ENCODE explained. Nature 489, 52-5.
- Online Mendelian Inheritance in Man (OMIM). An Online Catalog of Human Genes and Genetic Disorder [Internet, actualizado el 4 de junio de 2022]. Recuperado a partir de: http://www.omim.org
- Consejo Ejecutivo EB 116/3. 116ª reunión 21 de abril de 2005. Control de las enfermedades genétic [Internet] Organización Mundial de la Salud [citado el 6 de junio de 2022]. Recuperado a partir de: http:// apps.who.int/ gb/ebwha/pdf_files/EB116-REC1/B116_2005_ REC1-sp.pdf
- Eurordis:Organización europea de enfermedades raras [internet] [citado 06/06/2022] Recuperado a partir de: https://www.eurororg/content/what-rare-disease
- Medline Plus: [Internet][Citadoel 6 de junio de 2022] Recuperado a partir de: https://medlineplus.gov/spanish/genetica/entender/pruebas/tipos/
- M. Palacios-Verdú, L.A. Pérez-Jurado. Nuevas metodologías en el estudio de enfermedades genéticas y sus indicaciones. [Internet] [Citado el 6 de junio de 2022] Recuperado a partir de: https://www.pediatriaintegral.es
- Richards, , Aziz, N., Bale, S. et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 17, 405–423 (2015). https://doi.org/10.1038/gim.2015.30
- Blueprint White Paper: A guide to understanding variant classifica [Internet] [Citado el 7 de junio de 2022] Recuperado a partir de: https://blueprintgenetics.com/variant-classification/
- Harper Practical genetic counselling. 6th ed. Arnold: London 2003.
- Victòria Cusí. El Consentimiento Informado, un proceso importante para pacientes y profesionales de la salud [Internet] Guía Metabólica 2017 [citado el 6 de junio de 2022]. Recuperado a partir de: https://metabolicsjdhospitalbarcelona.org/noticia/consentimientoinformado-proceso-importantepacientes-profesionales-salu
- Green RC, Berg JS, Grody WW, Kalia SS, Korf BR, Martin CL, McGuire AL, Nussbaum RL, O’Daniel JM, Ormond KE, Rehm HL, Watson MS, Williams MS, Biesecker LG; American College of Medical Genetics and ACMG recommendations for reporting of incidental findings in clinical exome and genome sequencing. Genet Med. 2013 Jul;15(7):565-74. doi: 10.1038/gim.2013.73. Epub 2013 Jun 20. Erratum in: Genet Med. 2017 May;19(5):606. PMID: 23788249; PMCID: PMC3727274.
- Elliott AM. Genetic Counseling and Genome Sequencing in Pediatric Rare Disease. Cold Spring Harb Perspect Med. 2020 Mar 2;10(3):a036632. doi:10.1101/cshpera036632. PMID: 31501267; PMCID: PMC7050583.
Figura 1: Tipos de estudios genéticos y finalidades

Tabla 1: enfermedades genéticas más frecuentes (no exhaustiva), modos de herencia, mecanismo molecular principal
y edad de inicio.
*Datos de prevalencia obtenidos de Orphanet. +Datos referidos a población europea. AD: autosómico dominante.
AR: autosómico recesivo. XLD: ligado a X dominante. XLR: ligado a X recesivo. NA: no aplicable. PCR-RT: PCR a
tiempo real

Figura 2: Ilustración de las principales técnicas de diagnóstico genético.

Figura 3: Tipos y utilidad de los diversos estudios genéticos de secuenciación

Figura 4: Potencia diagnóstica y posibilidad de hallazgos de difícil interpretación en función del tipo de estudio de secuenciación
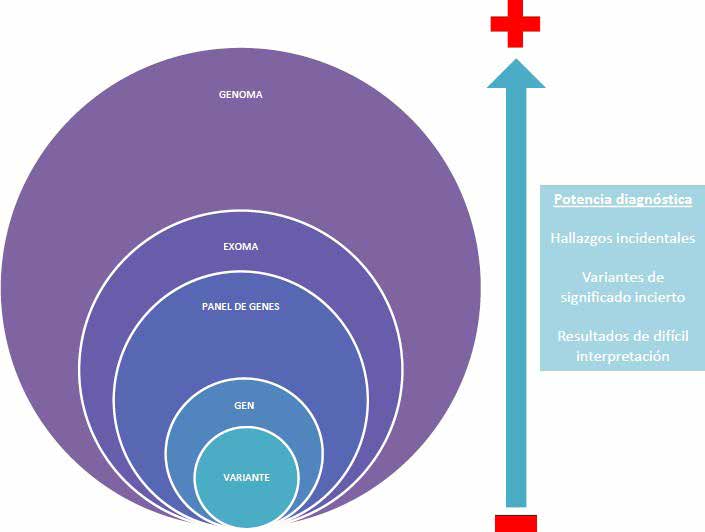
Tabla 2: Etapas del AG