Fernando Gómez Roda1, Juan Carlos Ramos Varela1, Cristina Perera Hernández2, Blanca Nieves Valenciano Fuente 2, Luis Peña-Quintana 1,3
Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil. Las Palmas
Unidad de Nefrología Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil. Las Palmas.
CIBER-OBN ISCIII. Asociación Canaria para la Investigación Pediátrica. Universidad de Las Palmas de Gran Canaria.
Asociación de enfermedades autoinmunes en la enfermedad celiaca
Resumen
La enfermedad celíaca (EC) es una enfermedad inflamatoria frecuente del intestino delgado, mediada por el sistema inmunitario y causada por la sensibilidad al gluten y las proteínas relacionadas, en individuos genéticamente predispuestos. Aunque la mayoría de los pacientes sintomáticos se relacionan con el tracto gastrointestinal, se han descrito otras manifestaciones extra-intestinales, como las enfermedades hepatobiliares, que producen elevaciones asintomáticas de los niveles de enzimas hepáticas o enfermedades renales, que producen proteinuria nefrótica y microhematuria con sustrato morfológico de nefropatía membranosa.
Describimos el caso clínico de un paciente que ha cursado con tres enfermedades autoinmunes: EC, hepatitis autoinmune (HAI) y nefropatía membranosa.
Palabras clave: Enfermedad celiaca, Enfermedades autoinmunes, Hepatopatía autoinmune, HLA, Nefropatía membranosa
Association of autoimmune diseases in celiac disease
Abstract
Celiac disease (CD) is a common inflammatory disease of the small intestine, mediated by the immune system and caused by sensitivity to gluten and related proteins in genetically predisposed individuals. Although most symptomatic patients are related to the gastrointestinal tract, other extraintestinal manifestations have been described, such as hepatobiliary diseases, which produce asymptomatic elevations of liver enzyme levels, or renal diseases, which produce nephrotic proteinuria and microhematuria with morphological substrate of membranous nephropathy.
We describe the clinical case of a patient with three autoimmune diseases: CD, autoimmune hepatitis (AIH) and membranous nephropathy.
Keywords: Autoimmune diseases, Autoimmune liver disease, Celiac disease, HLA, Membranous nephropathy
Introducción
La enfermedad celíaca (EC) es una entidad relativamente frecuente, estimándose una incidencia media en la población general del 0.5 al 1 por ciento. En Europa, Estados Unidos y Australia, las estimaciones de prevalencia oscilan entre 1:80 y 1:300 niños (3 a 13 por 1.000 niños)1.
Se considera una enfermedad sistémica de origen inmunológico que sucede en sujetos genéticamente predispuestos (antígenos HLADQ2 y/o DQ8), desencadenada por el consumo de gluten y otras prolaminas relacionadas contenidos en los cereales trigo, cebada, centeno, triticale, espelta, algunas variedades de avena, así como sus híbridos y derivados2,3.
La EC puede aparecer a cualquier edad y cursar con una clínica muy variada.
Los síntomas gastrointestinales son las manifestaciones clásicas más frecuentes, pero no los únicos, pudiendo debutar con manifestaciones no gastrointestinales o asociarse a otras enfermedades autoinmunes. La prevalencia de esta asociación es tres veces más frecuente en comparación con la población general, oscilando entre el 15 y 30 % en los pacientes celíacos adultos, siendo las más frecuente la tiroiditis de Hashimoto, la diabetes mellitus tipo I, el lupus eritematoso sistémico y la hepatitis autoinmune4. Asimismo, se ha constatado un aumento de enfermedades renales, entre las que destacan las glomerulonefritis, especialmente las nefropatías con depósitos mesangiales de IgA5.
Describimos el caso de un paciente con EC “no clásica” que debutó con hipertransaminasemia y que tras estudio dirigido finalmente se diagnosticó de hepatitis autoinmune (HAI). Tras varios años asintomático con buen control de la enfermedad, comenzó con proteinuria nefrótica, siendo diagnosticado de nefropatía membranosa (NM)6.
Caso clínico
Paciente de sexo masculino de nueve años que fue remitido por su pediatra a la Unidad de Gastroenterología, Hepatología y Nutrición Pediátrica de nuestro centro, por objetivar hipertransaminasemia asintomática en tres determinaciones seriadas tras un intervalo de cinco meses (Tabla I).
El paciente se encontraba asintomático, con antropometría y exploración normal, sin hepatoesplenomegalia.
Se realizó protocolo de hipertransaminasemia incluyendo hemograma, coagulación, bioquímica, CPK, virus hepatotropos, alfa-1-antitripsina, metabolismo del hierro, cobre, ceruloplasmina, inmunoglobulinas (IgA, IgG, IgM), autoinmunidad (ANA, DNA, ENA, músculo liso, mitocondria, LKM, citosol hepático tipo 1) y ecografía abdominal con resultados normales.
Se objetivó elevación de las cifras de transaminasas (tabla 2), anticuerpos anti-endomisio IgA (AAE) positivos a títulos 1:320, anticuerpos anti-transglutaminasa IgA (AATTG2) superiores a 200 U/mL y HLA DQ8 positivo.
Siguiendo los criterios ESPGHAN7 se diagnosticó de EC y se instauró dieta sin gluten. En los controles evolutivos se normalizaron los marcadores celiacos sin descenso de las transaminasas (tabla II). Por un aumento progresivo y significativo de las mismas se realizó una biopsia hepática en la que se objetivó “tejido hepático con inflamación aguda de predominio polimorfonuclear, eosinófilos aislados de localización periportal y lobulillar, focos de necrosis hepatocitaria, sin signos de fibrosis, colestasis ni otras alteraciones sugestivas de Hepatitis autoinmne”.
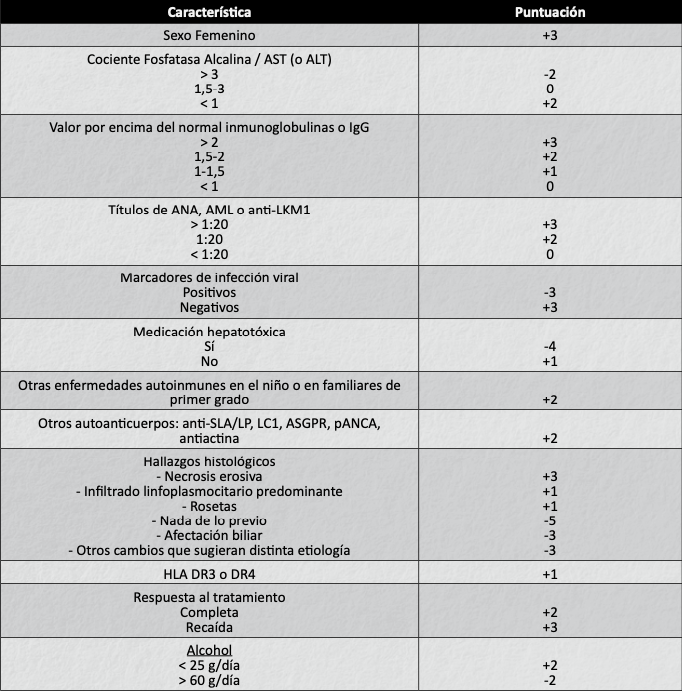
En la puntuación del Grupo Internacional de HAI (tabla III) se obtuvo una puntuación de 11 (probable HAI)8, por lo que se inició tratamiento con prednisona a 1 mg/kg/día. En controles sucesivos se observó descenso paulatino de las cifras de AST y ALT (tabla 2), añadiéndose azatioprina (1,5 mg/kg/día, tras comprobación de actividad de TPMT normal) y disminuyendo progresivamente los corticoides hasta una dosis final de mantenimiento de 0,2 mg/kg/día, lográndose normalización de las cifras de transaminasas.
A los tres años del diagnóstico de la EC y HAI, el paciente acudió al Servicio de Urgencias por presentar edemas en párpados y miembros inferiores objetivándose en la analítica hipoalbuminemia, hipoproteinemia, proteinuria en rango nefrótico, hipercolesterolemia e hipertrigliceridemia, siendo ingresado con el diagnóstico de sospecha de síndrome nefrótico. Precisó tratamiento con enalapril, hidroclorotiazida y atorvastatina para control clínico de los edemas, proteinuria e hiperlipidemia. Se realizó biopsia renal para tipificación de la alteración anatomopatológica, que determinó la presencia de nefropatia membranosa. Se completó el estudio de complemento, autoinmunidad (anticuerpos antitiroideos microsomiales, antitiroglobulina, antiadrenales, antireceptor fosfolipasa A2, antisustancia intercelular, anti membrana basal) con resultados normales.
Actualmente el paciente se encuentra asintomático, con buen control de la EC, de la HAI y de la nefropatía membranosa, siguiendo tratamiento con corticoides (0,2 mg/kg/día) y azatioprina (1,5 mg/kg/día).
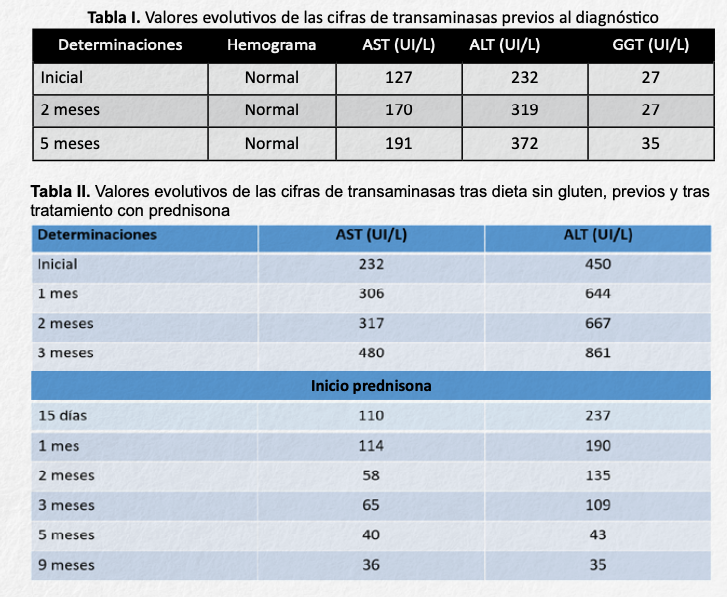
Tabla III: Sistema de puntuación para el diagnóstico de hepatitis autoinmune (ref. 8)
Discusión
El diagnóstico de EC se realiza principalmente a través del estudio de la AATG29,10 y sólo en determinadas ocasiones se precisa biopsia intestinal. A partir del año 2012 con los nuevos criterios de la ESPGHAN7 el diagnóstico de EC se puede realizar sin biopsia intestinal cuando los AATG2 son superiores a 10 veces su normalidad, exista elevación de los AAE y presente un estudio genético compatible (haplotipos de HLA DQ2 y DQ8)11. En 2020 estos criterios fueron renovados12, manteniéndose los criterios para AATG2 y AAE y reservándose la determinación de HLA-DQ2 y/o DQ8 a aquellos casos dudosos. En nuestro caso no hizo falta biopsia intestinal por presentar anticuerpos característicos de EC 10 veces superiores a los normales, HLA compatible y AAE positivos.
En nuestro paciente cabe destacar que tanto la EC como la HAI, no se acompañaba de sintomatología clínica, sino de hipertransaminasemia prolongada, normalizándose los marcadores celíacos tras la retirada de gluten sin mejoría de la hipertransaminasemia. Tras aplicar la puntuación del Grupo Internacional de HAI (tabla III) se estableció el diagnóstico de presunción de HAI8, a pesar de que la biopsia hepática no era característica de la misma, no presentaba marcadores de autoinmunidad (característico de la HAI asociada a EC)13 y tampoco hipergammaglobulinemia IgG. Más recientemente la ESPGHAN ha formulado una nueva propuesta de criterios diagnósticos para la enfermedad hepática autoinmune14. Tras iniciar tratamiento empírico con corticoesteroides se observó una relación clara con el descenso de transaminasas, confirmando el diagnóstico de HAI (puntuación del Grupo Internacional de HAI de 13).
Se han descrito múltiples patologías hepatobiliares relacionadas con la EC que incluyen elevaciones asintomáticas de los niveles de enzimas hepáticas, hepatitis inespecífica, enfermedad del hígado graso no alcohólico, enfermedad hepática autoinmune y colestásica. Frecuentemente, los niveles de enzimas hepáticas se normalizan con la retirada del gluten de sus dietas; sin embargo, nuestro paciente precisó uso de corticoterapia e inmunomoduladores para disminuir la actividad autoinmune hepática, típico de las HAI.
En cuanto a la asociación de la EC con patología nefrológica se encuentra descrita una posible afectación extraintestinal renal siendo mayoritariamente nefropatía por depósito de IgA en la membrana glomerular, que se describe hasta en un 3 % de pacientes celíacos3. Por otro lado, cabe mencionar que previo al diagnóstico de nefropatía membranosa, nuestro paciente había comenzado tratamiento con azatioprina, que no se asocia al desarrollo de esta patología, sino que por el contrario es un fármaco que puede usarse como tratamiento de la misma en combinación con corticoides15.
La asociación de patologías autoinmunes es una característica estudiada ampliamente y objetivada en el caso descrito, coexistiendo tres patologías autoinmunes que han ido apareciendo y sucediendo durante el seguimiento evolutivo del mismo a lo largo de los años. Creemos que la base genética de estas patologías puede ser objeto de estudio para el mejor entendimiento de las mismas, traduciéndose en una mejora en la atención que reciben nuestros pacientes.
Conclusiones
Las anomalías hepáticas son una forma común de manifestación extraintestinal en pacientes con EC. Las pruebas serológicas para la EC deben ser parte del estudio general de los pacientes con niveles elevados de enzimas hepáticas inexplicables si se han descartado las causas más comunes de la enfermedad hepática.
En la mayoría de los pacientes, se espera que los niveles elevados de enzimas hepáticas mejoren o se normalicen con el cumplimiento de una dieta sin gluten.
La EC también se asocia con HAI. En esta situación, aunque está indicada una dieta sin gluten, la adherencia a la misma tiene un impacto desconocido en el curso de la enfermedad hepática.
La aparición de proteinuria en pacientes con EC suele deberse mayoritariamente a nefropatía por depósito de IgA en la membrana glomerular; aunque también puede ser secundaria a nefropatía membranosa.
Bibliografía
1. Gujral N, Freeman HJ, Thomson AB. Enfermedad celíaca: prevalencia, diagnóstico, patogenia y tratamiento. World J Gastroenterol. 2012; 18:6036-59.
2. Green PH, Cellier C. Celiac disease. N Engl J Med. 2007; 357:1731-43.
3. Donat Aliaga E, Polanco Allue C, Ribes-Koninckx C. En: Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, ed. Tratamiento en gastroenterología, hepatología y nutrición pediátrica. 5ª edición. Madrid: Ergon; 2021. p. 201-212.
4. Vajro P, Paolella G, Maggiore G, Giordano G. Pediatric celiac disease, cryptogenic hypertransaminasemia, and autoimmune hepatitis. J Pediatr Gastroenterol Nutr. 2013; 56:663-70.
5. Pasternack A, Collin P, Mustonen J, Reunala T, Rantala I, Laurila K et al. Glomerular IgA deposits in patients with celiac disease. Clin Nephrol.1990; 34:56-60.
6. Soro S, de la Nieta SDS, Rivera F. Enfermedad celíaca y nefropatía membranosa. NefroPlus. 2009;29:479-81.
7. Husby S, Koletzko S, Korponay-Szabo IR, M L Mearin, A Phillips, R Shamir et al. ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012; 54:136-160.
8. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999; 31:929-938.
9. Ferre-López S, Ribes-Koninckx C, Genzor C, Gamen S, Peña L, Ortigosa L, et al. Immunochromatographic sticks for tissue transglutaminase and antigliadin antibody screening in celiac disease. Clin Gastroenterol Hepatol 2004; 2:480-484.
10. Baviera LC, Aliaga ED, Ortigosa L, Litwin N, Peña-Quintana L, Méndez V et al. Celiac disease screening by immunochromatographic visual assays: results of a multicenter study. J Pediatr Gastroenterol Nutr 2007; 45:546-550.
11. Peña-Quintana L, Torres-Galván MJ, Déniz-Naranjo MC, Ramos-Varela JC, Calvo-Hernández F, Fiuza-Pérez MD et al. Assessment of the DQ heterodimer test in the diagnosis of coeliac disease in the Canary Islands (Spain). J Pediatr Gastroenterol Nutr 2003; 37:604-608
12. Husby S, Koletzko S, Korponay-Szabó I, Kurppa K, Mearin ML, Ribes-Koninckx C, et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition. Guidelines for diagnosing coeliac disease 2020. J Pediatr Gastroenterol Nutr 2020; 70:141-156.
13. Urruzuno Telleria P, Camarena Grande C. Hepatopatías autoinmunes. En: Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, ed. Tratamiento en gastroenterología, hepatología y nutrición pediátrica. 4ª ed. Madrid: Ergon 2016, pp. 441-457.
14. Mieli-Vergani G, Vergani D, Baumann U, Czubkowski P, Debray D, Dezsofi A et al. Diagnosis and Management of Pediatric Autoimmune Liver Disease: ESPGHAN Hepatology Committee Position Statement. J Pediatr Gastroenterol Nutr 2018; 66:345-360.
15. Gutiérrez-Solís E, Fernández Juárez G. Uso de anticalcineurínicos en glomerulonefritis primarias y secundarias. NefroPlus 2010; 3:16-27.
