Eduardo Valerio Hernández1, Alejandra González Delgado2, Carmen Rosa Rodríguez Fernández-Oliva3, Mercedes Murray Hurtado4, Luis Peña Quintana5, Mónica Ruiz Pons6
1Pediatra de Atención Primaria en C.S Casco-Botánico (Puerto de la Cruz). Gerencia de Atención Primaria de Santa Cruz de Tenerife. 2Bioquímica clínica. Responsable del Laboratorio de Cribado Neonatal de Canarias. Complejo Hospitalario Universitario de Canarias. 3Pediatra. Coordinadora regional de Pediatría Hospitalaria y de Atención Primaria. Programas asistenciales. Servicio Canario de Salud. 4Pediatra. Unidad de Nutrición y Metabolopatías del Complejo Hospitalario Universitario de Canarias. 5Pediatra. Unidad de Gastroenterología y Nutrición Pediátrica. Complejo Hospitalario Universitario Insular Materno-Infantil de Las Palmas. CIBEROBN. ACIP. Universidad de Las Palmas de Gran Canaria. 6Pediatra. Unidad de Nutrición y metabolopatías del Complejo Hospitalario Universitario Nuestra Señora de la Candelaria
Resumen
El cribado neonatal ampliado (CNA) en Canarias incluye 8 enfermedades: PKU, AG-1, MCAD y LCHAD, fibrosis quística, hipotiroidismo congénito, anemia de células falciformes, y déficit de biotinidasa. A pesar de ello, el margen de mejora es amplio, con la posibilidad de aumentar las enfermedades cribadas mediante espectrometría de masas en tándem (MS/MS) a más de 20, sin aumento de coste, disponer de perfiles metabólicos más amplios y obtener los resultados en un tiempo adecuado. La formación y conocimiento sobre las enfermedades cribadas por parte de la pediatría, y medicina en general, suele ser bajo, a pesar de que las actuaciones y consecuencias de las mismas sobre estos pacientes, en determinadas enfermedades, son muy importantes. Los objetivos de este artículo son presentar la ampliación del cribado neonatal, los valores de referencia y una introducción a las enfermedades metabólicas cribadas y su manejo, principalmente desde el punto de vista del pediatra de primaria, cubriendo las posibles dudas que se puedan presentar.
Palabras clave: errores congénitos del metabolismo, cribado neonatal, espectrometría de masas en tándem, fenilcetonuria, aciduria glutárica tipo 1, beta-oxidación, deficiencia de biotinidasa
Expanded Newborn Screening in Canary Islands: an update. New diseases and future perspectives
Abstract
Expanded Newborn Screening (NBS) in the Canary Islands includes 8 diseases: PKU, AG-1, MCAD and LCHAD, cystic fibrosis, congenital hypothyroidism, sickle cell anemia, and biotinidase deficiency. Despite this, there is a wide space for improvement, with the possibility of increasing the number of diseases screened by tandem mass spectrometry (MS/MS) to more than 20, without increasing cost, having broader metabolic profiles and obtaining the results in a timely manner. Training and knowledge about the diseases screened by paediatrics, and medicine in general, is usually low, despite the fact that the actions and consequences of these on these patients, in certain diseases, are very important. The objectives of this article are to present the expansion of neonatal screening, the reference values and an introduction to the metabolic diseases screened for and their management, mainly from the point of view of the primary care pediatrician, covering any possible doubts that may arise.
Keywords: inborn errors of metabolism, newborn screening, tandem mass spectrometry, phenylketonuria, glutaric aciduria type 1, beta-oxidation, biotinidase deficiency
Introducción
El Cribado Neonatal Ampliado (CNA) en Canarias comenzó en el año 2015 tras la reunión del Consejo interterritorial en julio de 2013 y posterior informe del Grupo de trabajo de la Comisión de Salud Pública para el desarrollo del Sistema de Información sobre Cribado Neonatal. Se establecieron los objetivos y requisitos de calidad del Programa de Cribado Neonatal de enfermedades endocrino-metabólicas del Sistema Nacional de Salud a nivel nacional1, los cuales llevaron a la ampliación del cribado neonatal en toda España a, como mínimo, las 8 enfermedades que son cribadas actualmente, siendo en el caso de Canarias la fenilcetonuria (PKU), hipotiroidismo congénito (HtC), fibrosis quística (FQ), aciduria glutárica tipo 1 (AG-1), déficit de acil-CoA de cadena media (MCAD), déficit de 3-hidroxiacil-CoA de cadena larga (LCHAD) y anemia de células falciformes, añadiéndose en septiembre de 2021 el déficit de biotinidasa.
Existen diferentes programas de cribado neonatal (PCN) diseñados en función de la organización asistencial y recursos destinados a los programas de prevención en cada Comunidad Autónoma, todos ellos reconocidos en los diferentes sistemas sanitarios, como programas esenciales de prevención en Salud Pública. Éstos están integrados en la actividad asistencial de las diferentes unidades pediátricas, por lo que los PCN no deben identificarse solo con un procedimiento técnico o de laboratorio, sino como una actividad coordinada del sistema sanitario que asegure su eficacia y eficiencia2. Se han definido criterios para que un trastorno se incluya en el screening masivo:
- La gravedad de la enfermedad, que cursa con morbilidad (retraso mental) o mortalidad si no se diagnostica en el período neonat
- Exista un tratamiento efic
- La frecuencia de la enfermedad sea relativamente elevada (al menos, 1 de cada 10.000-15.000 RN); y que exista un método analítico de cribado rápido, fiable y de bajo coste (Wilson & Jungner, 1968)3. Estos criterios serían garantía para que se cumpla el objetivo principal de este tipo de programas: “el máximo beneficio con el mínimo de costes”, pero que actualmente han quedado obsoletos, renovándose con nuevas perspectivas gracias a la nueva tecnología de Espectrometría de Masas en Tándem (MS/MS) e incluso en un contexto de cribado genético4.
El Programa de Diagnóstico Precoz de Metabolopatías Congénitas en el Recién Nacido de la Comunidad Autónoma de Canarias, dependía desde el año 1981 y hasta el primer trimestre del año 2021 del Departamento de Pediatría de la Universidad de La Laguna, mediante un convenio firmado con la Consejería de Sanidad del Gobierno Autónomo. Al terminar dicho convenio la Unidad de Cribado Neonatal de Canarias pasa a depender del Servicio Canario de Salud y tras la presentación de los proyectos de 3 laboratorios de hospitales canarios (CHUC, CHUNSC y CHUIMI), se adjudica la Unidad al Hospital Universitario de Canarias. Esto supone una nueva etapa en el cribado, con posibilidades de ampliación, mejoras en recursos humanos y materiales y centralización de las muestras5.
En octubre de 2021 se incorporó el cribado de una octava enfermedad, la deficiencia de biotinidasa, con la determinación de su actividad mediante fluorimetría en la misma muestra de sangre seca en papel utilizada para el resto de enfermedades.
Una de las grandes debilidades en el diagnóstico y seguimiento de los pacientes con metabolopatías en Canarias siempre ha sido su condición de región ultraperiférica. La explicación es que, hasta el momento, disponemos para el diagnóstico bioquímico de los Errores Congénitos del Metabolismo (ECM) de bioquímica sanguínea rutinaria (EAB, glucosa, amonio, láctico, pirúvico, perfil hepático y renal, etc.) y las determinaciones de fenilalanina (Phe), a través del Laboratorio de Cribado Neonatal. El perfil de aminoácidos (AA), acilcarnitinas (AC) y ácidos orgánicos (AO) como pruebas de primera línea no están disponibles en ninguno de los hospitales, y han de ser enviados a laboratorios nacionales, con un tiempo mínimo estimado de envío de muestras de 2-3 días (según tipo de envío, mensajería y día de la semana), y con tiempo de respuesta aproximado de 1-3 semanas, según laboratorio y la técnica a realizar. Este hecho se exacerba en el caso de las urgencias metabólicas, las cuales, sin poder obtener una aproximación diagnóstica en menos de 24-48 horas, ya que el tiempo de espera, en el mejor de los casos, se puede alargar hasta los 5-7 días, obliga a manejar pacientes con enfermedades metabólicas complejas, muy graves, casi a ciegas. Los profesionales que actualmente desempeñan la labor de especialistas en ECM de los tres principales hospitales de las islas se enfrentan a situaciones en su práctica clínica diaria que requieren de este tipo de pruebas bioquímicas, imprescindibles para un correcto diagnóstico u orientación diagnóstica, en el menor tiempo posible para el inicio rápido y preciso de un tratamiento adecuado. Es evidente que la atención a este tipo de pacientes no es equiparable a otro tipo de patologías, y estamos en clara desventaja con el resto del territorio nacional, llevando indiscutiblemente a una mayor morbimortalidad en este tipo de enfermedades.
Muchos de estos pacientes en los dos primeros años de la vida, requieren controles mensuales (e incluso semanales o diarios, en algunos casos) para poder realizar un correcto tratamiento y seguimiento de su enfermedad. El control evolutivo de pacientes con ECM está condicionado por el aumento de los costes en los envíos de muestras, necesarios para un mínimo y correcto seguimiento, y ello sin contar con las pruebas de segundo nivel. Los tiempos entre el envío de muestras – análisis de primer y segundo nivel –, y la respuesta con los resultados, son largos en la mayoría de los casos; y la diferencia de tiempo entre la actitud terapéutica a tomar que condicionan los resultados obtenidos de esas pruebas impiden un adecuado control y seguimiento de los pacientes. En algunos casos, obliga a que sea necesario trasladar al paciente a hospitales de referencia (Madrid, Barcelona) donde se acorten los tiempos de espera de las pruebas complementarias necesarias, con el consiguiente sobrecoste para la administración y la familia. Actualmente, el laboratorio central del Complejo Hospitalario Universitario de Canarias está trabajando para incorporar en los próximos meses las determinaciones analíticas que ayuden en la confirmación de los casos positivos de cribado que son derivados a las unidades clínicas de referencia así como en el seguimiento de los casos confirmados, lo que supone el mayor avance para los enfermos y especialistas en metabolopatías hasta el momento.
El cribado de estas enfermedades, excepto la última incorporada en el programa de cribado, se lleva a cabo mediante espectrometría de masas en tándem (MS/MS).
Con la incorporación de esta tecnología en los programas de cribado es posible la determinación de múltiples enfermedades utilizando la misma técnica analítica y una cantidad de muestra muy reducida6. Las muestras que presenten valores alterados en los marcadores seleccionados para su cribado requieren ser confirmadas con solicitud de una segunda muestra. Si los resultados se confirman en esta muestra adicional, se considera positivo para el cribado y se deriva a la unidad clínica de referencia.
En el cribado de la PKU a partir del perfil de aminoácidos se lleva a cabo la cuantificación de los niveles de fenilalanina y el cociente fenilalanina/tirosina que se encuentran elevado en los casos de PKU. Es importante que la toma de muestra se realice después de haber recibido la toma de alimento en el recién nacido y considerar los posibles falsos positivos en el cribado de esta enfermedad si el recién nacido ha recibido nutrición parenteral previa a la toma de muestra. En esos casos, es importante recoger esta información en los formularios de toma de muestra para la correcta interpretación y remitir una segunda muestra a las 72 horas de la interrupción de la nutrición parenteral para confirmar/ descartar el falso positivo de la primera7,8. Para el cribado de la MCAD, LCHADD Y AG-I se analiza el perfil de acilcarnitinas. En la MCAD: C8, C6, C10, C10:1, C8/C10, C8/ C29; para el LCHAD: C16-OH, C18-OH y la C18:1-OH, C18:2-OH, C16:1-OH, C14-OH, C14:1-OH, C16-OH/C16 Y C18-OH/C1810; por último, para la AG-I: C5DC y los cocientes como C5DC/C8, C5DC/C16, C5DC/C0, C5DC/C5OH y C5DC/C3DC11.
Fenilcetonuria (PKU)
Descrita en el año 1934 como Oligofrenia Fenilpirúvica por A. Fölling (1934)12 y L. Penrose (1935)13, es el modelo de enfermedad mendeliana (un gen, una enfermedad), de herencia autosómica recesiva (AR), se caracteriza bioquímicamente por un aumento de la Phe en sangre debido al déficit funcional de la fenilalanina hidroxilasa (PAH, 12q23.2, OMIM #261600), enzima esencial en el paso de la Phe a Tyr (Figura 1). Dicha alteración conlleva una disminución de los aminoácidos largos neutros (↓ LNAA (LNAAT): Trp, Tyr, Hys, Met, Thr ) y aminoácidos de cadena ramificada (Leu, Ile y Val), tanto a nivel absortivo intestinal como de transportadores a nivel cerebral, causando un déficit de los mismos14.
Con una incidencia que varía por regiones, y que en Canarias se sitúa en el 1:10.222 hab. (año 2016)15, la clínica de la fenilcetonuria se considera que es multifactorial, no sólo la elevación de la Phe causa los síntomas y signos de la enfermedad, y comprende desde fallo de medro, retraso mental, microcefalia, alteraciones del metabolismo ósea y alteraciones neuropsicológicas16, pudiendo éstas últimas aparecer a pesar de un control metabólico óptimo, tales como el trastorno por déficit de atención con hiperactividad, alucinaciones, convulsiones, alteraciones en pruebas radiológicas (RMNc), alteraciones del comportamiento, etc17.
El diagnóstico, tal y como se ha explicado previamente, se realiza mediante el cribado neonatal desde el año 1981 en Canarias. Los valores de referencia actuales son una Phe > 97 µmol/L y el cociente Phe/Tyr, mucho más específico y cuyo valor > 1,7 sugiere dicha enfermedad. Las pruebas de confirmación son determinación de aminoácidos en sangre y orina, así como el estudio de pterinas en orina, que descartan una alteración en la síntesis y regeneración del cofactor16. Posteriormente, y con el objetivo de dar un buen consejo genético, se realiza el estudio de mutaciones del gen PAH. Actualmente, la mayor base de datos de mutaciones y sus repercusiones la podemos encontrar en BioPKUdb.org. En Canarias, la mutación más prevalente es la p.R408W, que es a su vez la más frecuente a nivel mundial, pero cuya frecuencia es prácticamente anecdótica en la zona mediterránea (incluyendo península). A pesar de ello, la mayor parte de los pacientes presentan formas benignas de PKU y se ha encontrado una nueva mutación no descrita previamente, p.P409L en un paciente de las islas orientales, referenciada en la base de datos internacional (http:// www.biopku.org/pah/result-details-pah. asp?ID=982)15.
El tratamiento de la fenilcetonuria desde que se conoce la alteración metabólica, es y ha sido el tratamiento dietético con control de la ingesta de fenilalanina. Gracias a productos ricos en aminoácidos y exentos de la fenilalanina, los pacientes pueden mantener la ingesta de dichos nutrientes controlando los niveles en sangre de la fenilalanina. Estos niveles no deben superar, o al menos es lo recomendado, los 360 µmol/L = 6 mg/dL. En el BOLCAN publicado en noviembre de 2021 sobre los tratamientos actuales de los ECM de diagnóstico mediante cribado neonatal de la Comunidad Canaria se resumen los tratamientos para la fenilcetonuria, incluyendo las fórmulas especiales (exentas de Phe) el diclorhidrato de sapropterina (Kuvan®)18 y los glucomacropéptidos (GMP), con una descripción de cada uno, modo de dispensación y dosificación19.
Hay dos tratamientos no abordados en el BOLCAN, por su carácter de no aprobación en Europa y por sus recientes comienzos. Unos son los aminoácidos largos neutros (LNAA en sus siglas en inglés), que vendrían a ser un equivalente de los GMP, recomendados en pacientes adultos con mal control metabólico por la dieta y que vendrían a competir con la Phe en los transportadores cerebrales e intestinales20. No están comercializados ni aprobados en la Unión Europea por la AEMPS. El otro se trata de un nuevo fármaco para esta enfermedad, el conjugado covalente de la proteína fenilalanina amonio liasa (rAvPAL) con NHS-metoxipolietilenglicol (NHS-PEG) (Palynziq®), una enzima de origen vegetal que degrada la Phe a amonio y ácido transcinámico, ambos totalmente inocuos para el ser humano. Indicado en pacientes mayores de 16 años con PKU de cualquier tipo siempre y cuando tenga un mal control metabólico y niveles > 600 µmol/L con tratamiento previo (aprobado en septiembre de 2020 por la EMA recientemente evaluado por la comisión interministerial de precios). Su uso en la actualidad está restringido a casos muy seleccionados por las unidades de referencia nacional de pacientes metabólicos en edad adulta y como uso compasivo. Se administra vía intramuscular y hay que controlar la posibilidad de que pueda causar una reacción alérgica grave21.
Habitualmente el paciente con PKU es muy agradecido, no requieren de muchos controles por primaria y no tienen descompensaciones que pongan en peligro su vida de forma inmediata, por lo que su control a este nivel es prácticamente el de un niño sano. No tienen contraindicación para ninguna vacuna, aunque en las primeras administraciones es recomendable el control de Phe en sangre mediante punción capilar y envio al laboratorio de cribado. Además, la lactancia materna se complementa, según el grado de hiperfenilalaninemia, con las fórmulas sin Phe y, en general, se mantiene en estos pacientes. Buscar en los fármacos recetados o complementos alimenticios el aspartamo, un edulcorante que básicamente es Phe con ácido aspártico (Asp), con el objetivo de evitarlo22.
Una consecuencia muy importante sobre el feto de pacientes PKU adultas que han tenido un mal control durante el embarazo es la fenilcetonuria materna, en la que los altos niveles de fenilalanina en sangre afectan al feto (no tiene por qué estar afecto de la enfermedad) como si de un síndrome alcohólico-fetal se tratase, pudiendo producir retraso del crecimiento intrauterino y postnatal asociado, microcefalia y discapacidad intelectual, malformaciones cardíacas congénitas y dismorfia facial. Estas alteraciones son muy similares a las descritas en los pacientes con fenilcetonuria clásica antes del tratamiento dietético actual. En estas pacientes está indicado el tratamiento con Kuvan® en casos de mal control16, 23
Aciduria glutárica tipo 1 (AG-1)
La aciduria glutárica tipo I (AG-1) es una enfermedad autosómica recesiva debida a la deficiencia de la enzima glutaril-CoA deshidrogenasa (GCDH, 19p13.2, OMIM #231670), responsable de la deshidrogenación y descarboxilación de glutaril-CoA en la vía de degradación de la lisina, hidroxilisina y triptófano (Figura 2). Los ácidos glutárico, 3-hidroxiglutárico, así como de glutarilcarnitina son neurotóxicos y se considera que su atrapamiento intracerebral es la causa principal de los mecanismos fisiopatológicos de esta enfermedad. Por ello es fundamental limitar en lo posible su formación.
El cuadro clínico agudo típico aparece entre los 6-18 meses de edad en que una enfermedad inespecífica, tal y como puede ser una infección respiratoria o gastrointestinal, e incluso tras una vacunación, se produce una crisis encefalopática aguda con un deterioro neurológico brusco y depresión del sensorio, irritabilidad, tendencia a opistótonos y convulsiones. Si no se trata precozmente provoca una destrucción y necrosis aguda de los ganglios basales (caudado y putamen). La consecuencia es un desorden distónico-disquinético similar a la parálisis cerebral, con afectación frecuente de la región orofacial, y que oscila desde una hipotonía extrema a coreoatetosis y rigidez con espasticidad. Este cuadro clínico puede no acompañarse de alteraciones importantes en la bioquímica habitual lo que dificulta el diagnóstico. El 75% de los pacientes tienen una presentación aguda en el primer año de vida, sin cribado neonatal. Existe una forma crónica y progresiva que aparece en el 25% de los casos, con síntomas inespecíficos como leve retraso global del desarrollo, disfunción motora sutil, asociada a distonías que se puede catalogar como una parálisis cerebral hipotónica-distónica. La macrocefalia es un síntoma asociado muy frecuente que puede ya estar presente desde el nacimiento. También pueden sufrir crisis encefalopáticas que agravan la sintomatología preexistente24.
El diagnóstico se realiza midiendo la excreción urinaria del ácido glutárico (AG), 3-hidroglutárico y glutarilcarnitina. Esta última también puede medirse en plasma en sangre impregnada en papel, método utilizado en el cribado neonatal. Existen 2 grupos bioquímicos bien definidos según la actividad enzimática residual, los altos excretores (AG > 100 mmol/mol creatinina) con nula actividad, y los bajos excretores (AG < 100 mmol/mol creatinina) con una actividad enzimática residual del 30%, estando en ambos siempre aumentado el ácido 3-hidroxiglutárico (aunque a veces sólo de forma intermitente) y la glutarilcarnitina en orina.
La detección precoz de esta enfermedad en el cribado neonatal mediante la medición de la glutarilcarnitina (C5DC) en sangre seca por espectrometría de masas en tándem tiene como objetivo el tratamiento precoz y seguimiento de los recién nacidos para reducir el riesgo de los trastornos neurológicos irreversibles. Se han descrito falsos negativos en aquellos pacientes clasificados como bajos excretores en los que la concentración de glutarilcarnitina puede ser normal. El diagnóstico definitivo se confirma mediante el estudio genético25. En España hay 4 variantes muy prevalentes, dos asociadas a fenotipo bioquímico de alta excreción (p.Ala293Thr y p.Arg402Trp, esta última es la más frecuente en caucásicos) y las variantes p.Val400Met y p.Arg227Pro asociadas a fenotipo bioquímico de baja excreción 26,27.
El objetivo principal del tratamiento es la prevención de las crisis encefalopáticas y el deterioro neurológico. Hasta el 90% de los individuos diagnosticados y tratados antes del desarrollo de síntomas, permanecerán asintomáticos, mientras que tiene un efecto escaso en el niño afectado neurológicamente, aunque puede prevenir un mayor daño cerebral. El tratamiento incluye una dieta baja en lisina (Lys) y reducida en triptófano (Trp) suplementación de carnitina, y un tratamiento de emergencia para las descompensaciones metabólicas. La dieta restringida en Lys y baja en Trp para disminuir la producción de los ácidos tóxicos (Figura1). La Lys representa el precursor mayoritario del ácido glutárico y 3-hidroxiglutárico ya que su contenido en las proteínas naturales se estima en un 2-9% frente al 0.6-2% del Trp. Una restricción severa de Trp puede traducirse en trastornos neurológicos graves. Se recomienda mantener el tratamiento dietético por lo menos hasta los 6 años de edad, que es el período más vulnerable para el desarrollo de crisis encefalopáticas, tras la cual su eficacia no ha sido sistemáticamente evaluada; sin embargo, dado que pueden seguir produciéndose cambios neuro-radiológicos de relevancia clínica no bien conocida, se aconseja evitar un aporte excesivo de proteínas naturales con alto contenido en lisina28.
El tratamiento farmacológico puede ser consultado en sus dosis en el BOLCAN19, haciendo mención en que todos los pacientes con AGI deben recibir carnitina para prevenir la deficiencia de carnitina y asegurar la homeostasis mitocondrial (la depleción de carnitina observada en la mayoría de los pacientes de debe a las pérdidas urinarias de glutarilcarnitina que exceden la capacidad de síntesis endógena). La riboflavina, al ser un cofactor de la glutaril-CoA deshidrogenasa se utiliza para intentar aumentar la actividad enzimática de ésta. Aunque algunos pacientes presentan una mejoría bioquímica disminuyendo las concentraciones de ácido glutárico en orina, no existen evidencias de que la riboflavina mejore el pronóstico clínico.
Los fármacos para los trastornos del movimiento, incluyen baclofeno y/o benzodiacepinas (diazepam), de primera línea para reducir los movimientos involuntarios y mejorar la función motora; anticolinérgicos como el trihexifenidilo (Artane®) de segunda línea y toxina botulínica para prevenir la luxación de la cadera y distonías de miembros
Es muy importante mantener un equilibrio metabólico en enfermedades intercurrentes, vacunaciones y otras situaciones que puedan provocar un estado catabólico. Esto incluye fiebre, diarrea, vómitos, dolor, trauma, ingesta escasa o una cirugía. Si el paciente tiene una clínica leve, temperatura < 38.5ºC y tolera alimentos, se recomienda un tratamiento domiciliario en las primeras 12 horas, a realizar por la familia y previamente educada para ello:
- Suspender 24 horas o disminuir la ingesta de proteínas naturales al 50% manteniendo la fórmula exenta de lisina.
- Añadir carbohidratos orales (maltodextrinas) diluidos en agua a concentraciones adecuadas a la edad para aumentar el aporte calórico y frenar el cat
- Doblar la dosis de carnitina (200 mg/kg/día).
- Antipiréticos: si la temperatura corporal > 38.5ºC.
- Se deben reintroducir las proteínas gradualmente no más tarde de las siguientes 24 horas si el paciente mejor
- Si no mejora en 24 horas, persisten los vómitos y diarreas, fiebre alta en picos o aparecen signos de alarma como irritabilidad, letargia, distonía, hipotonía que puede progresar a estupor en horas es necesario su ingreso hospit
En el seguimiento de estos pacientes se realiza monitorización clínica del crecimiento, bioquímica con los niveles de aminoácidos plasmáticos y carnitina libre, y control dietético estricto29.
Déficits de la beta-oxidación de ácidos grasos de cadena media (MCAD) y 3-hidroxilasa de cadena larga (LCHAD)
Se tratan de dos enfermedades que afectan a la denominada β-oxidación de los ácidos grasos, que es una parte de la vía encargada de la obtención de energía a partir de los ácidos grasos, y en la que se puede diferenciar 4 grandes bloques: ciclo de la carnitina, β-oxidación de los ácidos grasos, transferencia de electrones y síntesis de cuerpos cetónicos.
Así como el MCAD (ACADM, 1p31.1, OMIM #201450) tiene una incidencia de 1/10.000 RN, siendo la más frecuente del grupo de enfermedades de esta ruta metabólica, el LCHAD (HADHA, 2p23.3, OMIM #609016) se estima en 1/120.000 recién nacidos de manera global, aunque se cree que está infradiagnosticada y que ronda aprox. Los 1/50.000 RN. Ambas tienen una herencia AR y afectan a la vía metabólica a diferentes niveles que, resumiendo, es la escisión de acetil-CoA para su inclusión en el ciclo de Krebs, dejando el Acil-CoA con 2 moléculas de C menos. En el caso de la MCAD, la clínica predominante es la hipoglucemia hipocetósica, que puede acompañarse de acidosis láctica e hiperamoniemia, además de afectación hepática, síntomas neurológicos e incluso muerte súbita. No obstante, algunos pacientes pueden realizar hipoglucemia cetósica. Unos cursan de forma asintomática durante muchos años, sobre todo si no han sufrido episodios de ayuno o estrés metabólico y otros con crisis repetidas.
LCHAD también puede presentar hipoglucemia hipocetósica (aunque menos frecuente), las alteraciones hepáticas son prácticamente constantes y complicarse con descompensaciones agudas similares al síndrome de Reye, encefalopatía hepática, coma y muerte si no son tratados. Se suele observar rabdomiolisis y mioglobinuria durante las crisis. Otras alteraciones frecuentes son la cardiomiopatía dilatada o hipertrófica (infiltración grasa) con neuropatía periférica y central y miopatía (hipotonía y debilidad muscular), siendo prácticamente patognomónico de esta entidad la retinopatía pigmentaria. Las alteraciones cardiacas, a veces muy graves, suelen revertir con tratamiento adecuado30 (Figura 3). Un aspecto a destacar de la clínica que presenta el LCHAD es la presentación antenatal en la embarazada de hígado graso, preeclampsia o síndrome de HELLP, que se presenta hasta en un 80% de los casos de LCHAD en el niño (la madre sería portadora). Por ello, y según las guías clínicas, en toda gestante que presentase estos problemas, se ha de hacer un despistaje.
El diagnóstico, por supuesto, pasa por el cribado neonatal a través del MS/MS, objetivándose la elevación en el caso de la MCAD, sobre todo, de las acilcarnitinas C6, C8, C8/C2 y C8/C10, confirmándose posteriormente con AO (ácidos dicarboxílicos,
5-hidroxihexanoico y 7-hidroxioctanoico), acilglicinas en orina (hexanoilglicina y suberilglicina) y genética (ACADM), la cual tiene la característica de que el 90% de los casos presentan la mutación p.A985G, haciendo su estudio genético muy sencillo de realizar31.
En el caso del LCHAD, presenta un perfil de acilcarnitinas totalmente diferente, con aumentos, sobre todo, de C16-OH, C16:1-OH, C18-OH, C18:1-OH, C18:2-OH y C16-OH/C16. En AO en orina predomina la 3-OH-aciduria dicarboxílica, y el estudio de actividad enzimática en fibroblastos o linfocitos nos puede ayudar en el diagnóstico diferencial con las alteraciones de la cadena respiratoria, además de que la carnitina y las glucemias suelen ser más normales. Aquí también tenemos una mutación prevalente, en hasta en el 80% de los casos la G1528C (p.E510Q). En ambos casos, es prioritario prevenir las situaciones de catabolismo, tratando de que no se movilicen los ácidos grasos como substratos energéticos.
El tratamiento se basa fundamentalmente en acortar, según la edad, los períodos de ayuno y restringir el aporte graso con un incremento de los carbohidratos. En LCHAD se deben restringir los triglicéridos de cadena larga (LCT) al 10% y suplementar con triglicéridos de cadena media (MCT) con un total MCT+LCT = 20-35 % de la energía total. En la actualidad se encuentra en boga el uso de la triheptanoina (TH), un triglicérido sintético de cadena impar altamente purificado compuesto por 3 ácidos grasos de 7 carbonos esterificados con un glicerol, con función anaplerótica al formar succinil-CoA (intermediario del ciclo de Krebs)32,33. La TH (Dojolvi®) ha sido aprobada recientemente por la FDA y se puede administrar desde el período neonatal. Para el manejo dietético de los LCHAD durante la época de la lactancia existen preparados comerciales completos como Monogen® (Nutricia) o Lipistar® (Vitaflo)19. En pacientes con LCHAD, no hay consenso en cuanto al aporte de DHA, pudiéndose suplementar de forma sistemática o añadir aceite de nuez a la dieta34.
Para MCAD en la actualidad no se aconseja modificaciones dietéticas (excepto durante las agudizaciones) manteniendo un aporte lipídico normal (30-35% de las calorías). El lactante puede realizar lactancia materna o tomar las fórmulas infantiles habituales, estando contraindicado el MCT.
En cuanto al tratamiento farmacológico se debe instaurar de forma individual y según el déficit enzimático y consistirá básicamente en: a) carnitina: el empleo de este detoxificador permanece aún en controversia, siendo la tendencia actual a no prescribirla. Solo se debería valorar y con mucha precaución si sus niveles son bajos, administrándose a dosis bajas; b) preoperatorio: si el paciente requiere períodos de ayuno por cualquier intervención, incluidas extracciones dentales, se recomienda la administración intravenosa de suero glucosado al 10% antes, durante y después de la intervención; c) polivitamínico: se debe suplementar con un complejo polivitamínico y mineral que contenga todas las vitaminas liposolubles (A, D, E, K) por el riesgo de déficit, tras el tratamiento dietético. En investigación se encuentran otros fármacos.
Es aconsejable que los pacientes posean un documento de información (carta de urgencia) destinada a todos los médicos, en especial a los de urgencias para autorizar un pase preferente a urgencias y donde se describa la enfermedad, las circunstancias que generan riesgo de descompensaciones, los riesgos clínicos y las medidas a tomar en descompensaciones35,36.
Déficit de biotinidasa
Enfermedad del metabolismo de la biotina, causada por la ausencia o la deficiencia de la enzima biotinidasa en herencia AR (BTD, 3p25.1, OMIM #253260). Hasta la fecha se han identificado más de 100 mutaciones en el gen BTD causantes de enfermedad y se presenta con una frecuencia estimada de 1/40.000-60.000 recién nacidos vivos. La biotina es una vitamina hidrosoluble esencial que se obtiene de la dieta y se libera y recicla gracias a la acción de la biotinidasa; cuando existe un déficit enzimático, no se puede procesar de manera correcta la biotina tanto exógena como endógena, por lo que existe un déficit vitamínico que conlleva el bloqueo de varias vías metabólicas en las que se acumulan sustratos cuya toxicidad desencadena la clínica típica de la enfermedad no tratada.
La deficiencia de biotinidasa se clasifica en función de la cantidad de actividad residual enzimática: se considera deficiencia total cuando la actividad enzimática es inferior al 10%, desarrollándose así una clínica grave y precoz (primeros meses de vida), y deficiencia parcial si existe un 10-30% de actividad, siendo estos pacientes los que pueden permanecer oligoo asintomáticos, y tener clínica intermitente de gravedad variable por ejemplo en periodos de estrés metabólico. Existe por tanto gran heterogeneidad tanto en la edad de presentación como en la expresión clínica, que se caracteriza por afectación principalmente neurológica y cutánea: pueden presentarse crisis convulsivas rebeldes al tratamiento, hipotonía, ataxia, alopecia, dermatitis, conjuntivitis y retraso psicomotor. Otros posibles síntomas son estridor laríngeo, hiperventilación o apnea, neuropatía óptica, sordera neurosensorial o micosis debido a una alteración en la respuesta inmunológica, entre otros. Los casos más graves pueden llevar a coma e incluso a la muerte. Se describen anomalías en la neuroimagen y a nivel analítico, si bien estas manifestaciones no son en ningún caso específicas, y por tanto el diagnóstico diferencial es amplio.
Dadas las dificultades para realizar un diagnóstico clínico precoz, previo al inicio de las manifestaciones, así como la potencial gravedad del cuadro y la existencia de un tratamiento efectivo, unido a la facilidad y bajo coste de la determinación de la actividad de biotinidasa en gota de sangre en papel, esta enfermedad fue incluida por primera vez en programas de cribado neonatal en 1984 en otras comunidades y, en Canarias desde septiembre de 2021. Pueden existir, como en toda muestra de cribado, falsos positivos y falsos negativos, por lo que ante un resultado positivo en dos determinaciones, se debe realizar anamnesis y exploración completa del neonato, y confirmar el diagnóstico en el hospital de referencia solicitando analítica sanguínea completa y estudio genético. Todas las muestras deben ser extraídas antes de comenzar la suplementación con biotina, iniciándose inmediatamente tras la extracción de muestras, sin necesidad de esperar a resultados, ya que un diagnóstico y tratamiento precoces previenen la aparición de las manifestaciones clínicas y las alteraciones bioquímicas.
El tratamiento basa en la administración precoz e indefinida de 5-10 mg/día de biotina vía oral, demostrándose en la totalidad de los pacientes afectos una respuesta favorable si ya hubiera clínica, independientemente de la gravedad de la sintomatología, incluso revirtiendo la mayoría de la clínica tras el inicio del tratamiento, si bien los síntomas auditivos y oculares pueden ser permanentes. No son necesarias modificaciones dietéticas, y por tanto no se ha de contraindicar la lactancia materna ni variar la pauta de lactancia artificial si el neonato la recibe19. El déficit de biotinidasa si se diagnostica y trata en fase presintomática se convierte en una enfermedad de carácter benigno, que no suele presentar problemas de descompensaciones ante enfermedades intercurrentes o vacunaciones. El tratamiento es de por vida y el desarrollo del niño con el mismo suele ser habitualmente normal37.
Conclusiones
Las debilidades que hasta ahora presentaba el cribado neonatal en nuestra comunidad se van subsanando. El paso a depender de la Consejería de Sanidad por completo, de un programa de tan inmensa importancia para la población era esencial para poder avanzar. No obstante, gracias a que hubo personal implicado en su creación y desarrollo, podemos hoy hablar de cribado en nuestra provincia desde los inicios a nivel nacional. El profesor y catedrático de pediatría por la Universidad de La Laguna, ex decano de la Facultad de Medicina y rector de la misma universidad, y jefe del departamento de pediatría, el Dr. Eduardo Doménech Martínez y Dña. Flora Barroso Guerrero, profesora durante más de 30 años de la universidad y responsable del laboratorio de cribado, iniciaron en 1981 el programa de cribado, anteriormente con otra denominación (Foto 1), y cuya labor fue continuada hasta su paso al centro hospitalario por los doctores Ramón Castro Conde y Felícitas Díaz-Flores Estévez, además de los técnicos y administrativos que formaron parte en algún momento del cribado neonatal en Canarias. A ellos, el reconocimiento del camino andado.
Sin embargo, seguimos teniendo una gran debilidad con respecto a otras Comunidades Autónomas de nuestro país con cribado neonatal ampliado (Navarra -34, ampliado y aprobadas conjuntamente en 2021-38, Galicia -29-, Murcia -28-, Andalucía oriental, Andalucía occidental/Ceuta, Aragón/ La Rioja, Baleares, Cataluña y Extremadura -26-, Castilla la Mancha-21-, Madrid -19-), encontrándonos en el rango más bajo (-8-)39, lo que implica no diagnosticar de forma precoz un número significativo de enfermedades. Tampoco se ha tenido en cuenta la idiosincrasia de nuestra población, la presencia de enfermedades con mayor prevalencia en nuestro medio como la Tirosinemia tipo 1 y tipo 240, entre otras, ni la opinión de los profesionales que controlan a los pacientes con trastornos congénitos del metabolismo intermediario y otras enfermedades de rara presentación. El retraso diagnóstico de muchas de estas entidades puede llevar graves consecuencias al paciente, por no recibir un tratamiento precoz. En nuestra práctica clínica habitual, los familiares nos preguntan, con toda la razón, el motivo de no realizarse en nuestro medio el cribado ampliado y diagnosticarse tardíamente su enfermedad, hecho que no hubiera ocurrido si su hijo o hija hubiera nacido en otra Comunidad con cribado ampliado. No es equitativo ni igualitario para la población de nuestra Comunidad y mucho menos para los individuos afectos, por lo que abogamos e instamos por el cribado ampliado y conjunto al más alto nivel en la Comunidad Autónoma de Canarias sin demoras, en beneficio de nuestros pacientes.
De todas las enfermedades cribadas, destacar aquellas con posibilidad de descompensación aguda con consecuencias graves/letales. De ellas, debe conocer el profesional que se dedica a valorar niños en atención primaria los factores de riesgo, la sospecha de descompensación, su correcto manejo inicial y derivación urgente. A pesar de que los pacientes con metabolopatías han continuado el seguimiento por su pediatra de referencia hasta la edad adulta, al igual que en el resto del territorio español, ya se está trabajando en unidades de referencia para adultos, tanto en el HUNSC como en el Complejo Hospitalario Universitario Insular Materno-Infantil de Las Palmas y en el Hospital Universitario Dr. Negrín, a través de especialistas hospitalarios, generalmente de medicina interna, que comienzan a introducirse en el mundo de las metabolopatías y que van adquiriendo paulatinamente a los pacientes derivados desde los pediatras de referencia. Otra carencia demandada desde hace años por los pacientes adultos y que se va solventando.
Para todas estas enfermedades, en nuestra comunidad, parece que existe una asociación para pacientes, la Asociación PKU y otros trastornos del metabolismo (OTM), que si bien no aparece listada dentro de la Federación Española de Enfermedades Metabólicas Hereditarias (https://metabolicos.es/listado-asociaciones-enfermosmetabolicos-de-espana/), sí aparece en otros sitios, aunque con datos que parecen ya obsoletos. Retomar esta actividad podría ser más que recomendable y justificada. Queda todavía mucho por trabajar para mejorar la calidad de la atención a los pacientes metabólicos en nuestra comunidad.
Bibliografía
- Objetivos y requisitos de calidad del Programa de Cribado Neonatal de enfermedades endocrinometabólicas del Sistema Nacional de Grupo de trabajo de la Comisión de Salud Pública para el desarrollo del Sistema de Información sobre Cribado Neonata [Internet]. Disponible en: https:// www.mscbs.gob.es/profesionales/saludPublica/ prevPromocion/Cribado/docs/ObjetivosCribadoNeonatal.pdf
- González-Lamuño Leguina D, Couce Pico Cribado neonatal. Pediatr Integr [Internet]. 2019 [cited 2022 Feb 11];23:169.e1-169.e10. Disponible en: https://www.pediatriaintegral.es/publicacion-2019-05/cribado-neonatal/
- Wilson JMG, Jungner Principles and practice of screening for disease.
- King JR, Notarangelo LD, Hammarström L. An appraisal of the Wilson & Jungner criteria in the context of genomic-based newborn screening for inborn errors of immunity. J Allergy Clin Immunol [Internet]. 2021 [cited 2022 Feb 11];147:428–38. Disponible en: https://pubmed.ncbi.nlm.nih. gov/33551024/
- El HUC, designado Unidad de referencia en Canarias para la detección precoz de las metabolopatías [Internet]. Disponible en: https://ww gobiernodecanarias.org/noticias/el-huc-designado-unidad-de-referencia-en-canarias-para-la-deteccion-precoz-de-las-metabolopatias/
- Pandor A, Eastham J, Beverly C, Chilcott J, Paisley S. Clinical effectiveness and cost-effectiveness of neonatal screening for inborn errors of metabolism using tandem mass spectrometry: a systematic review. Health Technol Assess [Internet]. 2004 [cited 2022 Feb 11];8. Disponible en: https://pubmed.ncbi.nlm.nih.gov/14982654/
- Requisitos y recomendaciones para el desarrollo del programa de cribado neonatal de enfermedades endocrino-metabólicas en el SNS. Grupo de trabajo de protocolos de cribado neonat Ponencia de Cribado Poblacional de la Comisión de Salud Pública [Internet]. Disponible en: https:// www.mscbs.gob.es/profesionales/saludPublica/ prevPromocion/Cribado/docs/CribadoNeonatal_ EnfEndocrinometabolicas.pdf
- Protocolo de cribado neonatal de la fenilcet Grupo de trabajo. Grupo de trabajo de protocolos de cribado neonatal. Ponencia de Cribado Poblacional de la Comisión de Salud Pública [Internet]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/Cribado/docs/CribadoNeonatal_Fenilcetonuria.pdf
- J Lawrence Merritt 2nd, Chang IJ. Medium-Chain Acyl-Coenzyme A Dehydrogenase Deficiency. GeneReviews® [Internet]. 2019 [cited 2022 Feb 11]; Disponible en: https://www.ncbi.nlm.nih.gov/ books/NBK1424/
- Sykut-Cegielska J, Gradowska W, PiekutowskaAbramczuk D, Andresen BS, Olsen RKJ, Ołtarzewski M, et al. Urgent metabolic service improves survival in long-chain 3-hydroxyacyl-CoA dehydrogenase (LCHAD) deficiency detected by symptomatic identification and pilot newborn scr J Inherit Metab Dis [Internet]. 2011 [cited 2022 Feb 11];34:185–95. Disponible en: https://pubmed. ncbi.nlm.nih.gov/21103935/
- Lindner M, Ho S, Fang-Hoffmann J, Hoffmann GF, Kölker S. Neonatal screening for glutaric aciduria type I: strategies to pr J Inherit Metab Dis [Internet]. 2006 [cited 2022 Feb 11]; 29:378–82. Disponible en: https://pubmed.ncbi.nlm.nih. gov/16763905/
- Følling A. Uber ausscheidung von phenylbrenztraubensaure in den harn als stoffwechselanomalie in verbindung mit imbezillita Physiol Chem. 1934;169–76.
- Penrose BYL, Quastel JH, Lionel P, Hirsch QJ. Metabolic studies in phenylket 1937 [cited 2013 Nov 4];266–74. Disponible en: http://www.biochemj.org/bj/031/0266/bj0310266_browse.htm
- Schuck PF, Malgarin F, Cararo JH, Cardoso F, Streck EL, Ferreira GC. Phenylketonuria Pathophysiology: on the Role of Metabolic Altera Aging Dis [Internet]. 2015 [cited 2015 Oct 28];6:390–9. Disponible en: http://www.pubmedcentral.nih.gov/ articlerender.fcgi?artid=4567221&tool=pmcentrez&rendertype=abstract
- Valerio Hernández Fenilcetonuria en canarias. Estudio molecular del gen PAH en pacientes con fenilcetonuria e hiperfenilalaninemias de la comunidad canaria. 2016 [cited 2022 Feb 5]; Disponible en: https://dialnet.unirioja.es/servlet/ s?codigo=120319&info=resumen&idioma=SPA
- Wegberg AMJ van, MacDonald A, Ahring K, Bélanger-Quintana A, Blau N, Bosch AM, et The complete European guidelines on phenylketonuria: diagnosis and treatment. Orphanet J Rare Dis [Internet]. 2017 [cited 2021 Oct 25];12. Disponible en: /pmc/articles/PMC5639803/
- Moyle JJ, Fox AM, Arthur M, Bynevelt M, Burnett JR. Meta-analysis of neuropsychological symptoms of adolescents and adults with PKU. Neuropsychol Rev [Internet]. 2007 [cited 2015 Nov 14];17:91–101. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17410469
- Aldámiz-Echevarría L, Llarena M, Bueno MA, Dalmau J, Vitoria I, Fernández-Marmiesse A, et al. Molecular epidemiology, genotype-phenotype correlation and BH4 responsiveness in Spanish patients with phenylket J Hum Genet. 2016;61:731–44.
- Eduardo Valerio Hernández, Mónica Ruíz Pons, Luis Peña Quintana, Mercedes Murray Hurtado CR, Rodríguez Fernández-Oliva, Fidelina de la Nuez Viera, Mercedes Plasencia Núñez MLCP. Errores congénitos del metabolismo herramientas terapéutic Boletín Canar uso Racion del Medicam del SCS [Internet]. 2021;13:1–7. Disponible en: https://www3.gobiernodecanarias. org /sanidad/scs/content/f4657c2e-4160-11ecbda3-d3e6cfb1ac5c/BOLCAN ECM V13_n2_ set2021.pdf
- van Vliet D, Bruinenberg VM, Mazzola PN, van Faassen MHJR, de Blaauw P, Kema IP, et al. Large Neutral Amino Acid Supplementation Exerts Its Effect through Three Synergistic Mechanisms: Proof of Principle in Phenylketonuria Mice. PLoS One [Internet]. 2015 [cited 2015 Dec 5];10:e0143833. Disponible en: http://www.ncbi. nlm.nih.gov/pubmed/26624009
- Mahan K, Gandhi M, Anand A. Pegvaliase: a novel treatment option for adults with phenylket Curr Med Res Opin [Internet]. 2019 [cited 2021 Jul 10];35:647–51. Disponible en: https://pubmed. ncbi.nlm.nih.gov/30247930/
- Bravo P, Raimann E, Cabello JF, Arias C, Peredo P, Castro G, et ¿Qué debe saber el pediatra de las hiperfenilalaninemias? Rev Chil Pediatría [Internet]. 2015 [cited 2022 Feb 5];86:214–8. Disponible en: https://www.elsevier.es/es-revista- revista-chilena-pediatria-219-articulo-que-debesaber-el-pediatra-S0370410615000674
- Aldámiz-Echevarría L, Couce ML, Llarena M, Andrade F. A new case of maternal phenylketonuria treated with sapropterin dihydrochloride (6RBH4). Gynecol Endocrinol [Internet]. 2014 [cited 2015 Nov 23];30:691–3. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24927077
- Larson A, Goodman Glutaric Acidemia Type 1. GeneReviews® [Internet]. 2019 [cited 2022 Feb 14]; Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK546575/
- Boy N, Mühlhausen C, Maier EM, Heringer J, Assmann B, Burgard P, et al. Proposed recommendations for diagnosing and managing individuals with glutaric aciduria type I: second re J Inherit Metab Dis [Internet]. 2017;40:75–101. Disponible en: http://dx.doi. org/10.1007/s10545-016-9999-9
- Busquets C, Merinero B, Christensen E, Gelpí JL, Campistol J, Pineda M, et al. Glutaryl-CoA dehydrogenase deficiency in Spain: evidence of two groups of patients, genetically, and biochemically dis Pediatr Res [Internet]. 2000 [cited 2022 Feb 14];48:315–22. Disponible en: https://pubmed.ncbi.nlm.nih.gov/10960496/
- Couce ML, López-Suárez O, Bóveda MD, Castiñeiras DE, Cocho JA, García-Villoria J, et Glutaric aciduria type I: Outcome of patients with earlyversus late-diagnosis. Eur J Paediatr Neurol [Internet]. 2013 [cited 2016 Aug 9];17:383–9. Disponible en: http://linkinghub.elsevier.com/ retrieve/pii/S1090379813000068
- Ruiz Pons M, Sanchez Valverde F, Dalmau Serra J. Tratamiento nutricional de los Errores Innatos del Metabolismo [Internet]. 3a. Ergon, editor. Disponible en: https://ergon.es/wp-content/uploads/2015/08/n018_Tratam_nutricional_EIM_3ed.pdf
- Ribes A, Pérez-Dueñas B, Arranz JA, GarcíaVilloria J, Couce ML. Protocolo de diagnóstico, tratamiento y seguimiento de la aciduria glutárica tipo In: ERGON, editor. Protocolos de diagnóstico y tratamiento de los errores congénitos del metabolismo [Internet]. 2a. 2018. p. 205–2018. Disponible en: https://aecom.com.es/wpcontent/uploads/2018/01/protocolos-AECOM-2ed.pdf
- Peña-Quintana Alteraciones de la β-oxidación de los ácidos grasos y del sistema carnitina. In: Couce ML, Aldámiz-Echevarría L, García Jiménez C, González-Lamuño D, editors. Diagnóstico y Tratamiento de las Enfermedades Metabólicas Hereditarias. 5a. ERGON; 2022. p. 753–76.
- Ruiz-Sala P, Peña-Quintana Biochemical Markers for the Diagnosis of Mitochondrial Fatty Acid Oxidation Diseases. J Clin Med [Internet]. 2021 [cited 2022 Feb 14];10. Disponible en: https:// pubmed.ncbi.nlm.nih.gov/34768374/
- Roe CR, Sweetman L, Roe DS, David F, Brunengraber H. Treatment of cardiomyopathy and rhabdomyolysis in long-chain fat oxidation disorders using an anaplerotic odd-chain trigly J Clin Invest [Internet]. 2002 [cited 2022 Feb 14];110:259–69. Disponible en: https:// pubmed.ncbi.nlm.nih.gov/12122118/
- Vockley J, Burton B, Berry G, Longo N, Phillips J, Sanchez-Valle A, et Effects of triheptanoin (UX007) in patients with long-chain fatty acid oxidation disorders: Results from an open-label, long-term extension study. J Inherit Metab Dis [Internet]. 2021 [cited 2022 Feb 14];44:253–63. Disponible en: https://pubmed.ncbi.nlm.nih. gov/32885845/
- Gillingham MB, Connor WE, Matern D, Rinaldo P, Burlingame T, Meeuws K, et al. Optimal dietary therapy of long-chain 3-hydroxyacyl-CoA dehydrogenase deficiency. Mol Genet Metab [Internet]. 2003 [cited 2022 Feb 14];79:114–23. Disponible en: https://pubmed.ncbi.nlm.nih. gov/12809642/
- García Romero R, García Jiménez Trastornos de oxidación de ácidos grasos de cadena media: déficit de acil-CoA deshidrogenasa de cadena media (MCAD) y déficit de carnitina palmitoiltransferasa I (CPT 1). In: Aldámiz-Echevarría L, Couce Pico ML, González-Lamuño Leguina D, García Jimenez MC, editors. Enfermedades Raras Metabólicas Procedimientos de Urgencias y de Situaciones de Riesgo. 1a. 2017. p. 141–8.
- Peña-Quintana L, González Santana D. Trastornos de oxidación de ácidos grasos de cadena larga: deficiencia de acil-CoA deshidrogenasa de cadena muy larga (VLCAD), deficiencia de 3-hidroxiacilCoA deshidrogenasa de cadena larga (LCHAD), deficiencia de carnitina palmitoiltransferasa II (CPT 2). In: Aldámiz-Echevarría L, Couce Pico ML, González-Lamuño Leguina D, García Jiménez MC, editor Enfermedades Raras Metabólicas Procedimientos de Urgencias y de Situaciones de Riesgo. 1a. ergon; 2017. p. 149–64.
- Saleem H, Simpson B. Biotinidase Deficiency. StatPearls [Internet]. 2021 [cited 2022 Feb 14]; Disponible en: https://www.ncbi.nlm.nih.gov/ books/NBK560607/
- Ley foral 10/2021, de 18 de junio, por la que se regula el derecho al cribado neonatal ampliado en Navarr Boletín Oficial de Navarra de 25 de junio de 2021; BOE de 10 de julio de 2021.
- Marín Soria JL, González de Aledo Castillo JM, Argudo Ramírez A, López Galera RM, Pajares García S, Ribes Rubió A, et Inicio, evolución y situación actual de los Programas de Cribado Neonatal en España. Rev Esp Salud Publica. 2021;95.
- Peña-Quintana L, Scherer G, Curbelo-Estévez ML, Jiménez-Acosta F, Hartmann B, La Roche F, et al. Tyrosinemia type II: Mutation update, 11 novel mutations and description of 5 independent subjects with a novel founder muta Clin Genet [Internet]. 2017 [cited 2022 Feb 20];92:306–17. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28255985/
Figura 1. Ruta metabólica de la Phe y zonas de actuación del cofactor BH4. Esquema extraído de la tesis doctoral Fenilcetonuria en Canarias, 2016. Eduardo Valerio Hernández
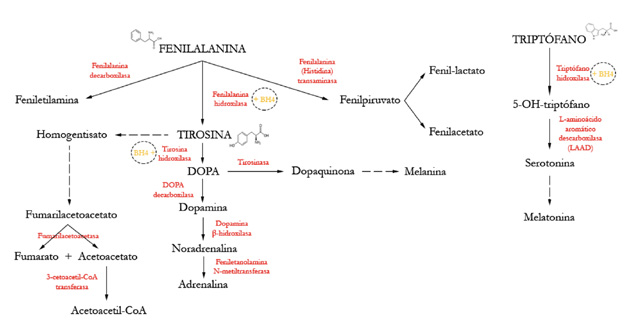
Figura 2. Vía catabólica del ácido glutárico. La glutaril- CoA deshidrogenasa realiza la deshidrogenación y la decarboxilación de glutaril-CoA a crotonil-CoA. En estos pacientes ambos pasos están bloqueados, acumulándose ácido glutárico, 3-OH-glutárico, glutacónico y glutarilcarnitina
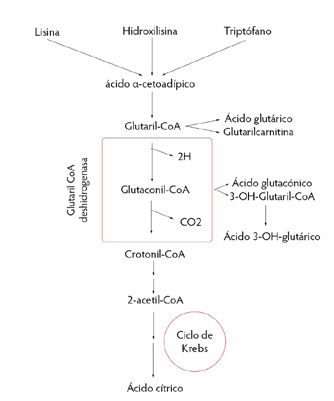
Figura 3. Defecto de la oxidación de ácidos grasos durante el ayuno y el estrés y sus consecuencias en los diferentes órganos afectados
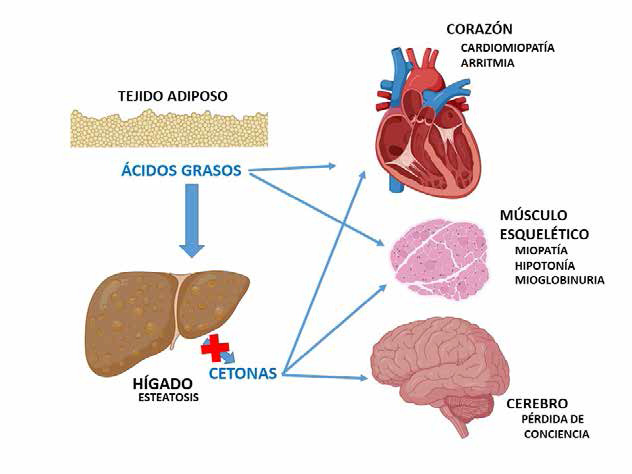
Foto 1. Antigua denominación del programa de cribado neonatal. Foto de la placa en la antigua 3ª fase de la Facultad de Medicina o Facultades de enfermería y fisioterapia.


