Víctor M. García Nieto, Iván González Díaz, Teresa Moraleda Mesa, Patricia Tejera Carreño, María Isabel Luis Yanes
Sección de Nefrología Pediátrica. Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife
Introducción
En el primer artículo de esta serie, exponíamos los conocimientos que se han ido adquiriendo en las últimas décadas acerca de las bacterias que suelen producir infección urinaria (IU) en la infancia, especialmente, Escherichia coli1. En este segundo capítulo de la serie, repasamos los conocimientos adquiridos sobre la afectación del parénquima renal en algunos casos de IU y de reflujo vesicoureteral (RVU).
Hodson y Edwards, 1969. Se establece la asociación entre pielonefritis crónica y reflujo vesicoureteral2
Las lesiones renales permanentes que se observan en niños después de padecer una o varias infecciones urinarias (IU) febriles, han recibido varias denominaciones en los últimos decenios. El primer nombre empleado fue el de “pielonefritis crónica”3,4. Se trata de un término difícil de comprender en la actualidad. En necropsias de pacientes, sobre todo niños, fallecidos después de padecer una pielonefritis aguda5,6 y en animales de experimentación con IU inducidas7, se observaba la persistencia de bacterias en el parénquima renal junto a zonas de fibrosis y de desaparición de glomérulos (figuras 1 y 2). Este hecho puede atribuirse a la ausencia de antibióticos eficaces en su momento hace decenios y a la difícil llegada de esos fármacos a las zonas cicatrizales correspondientes a las zonas de parénquima renal destruido7 y quería indicar que podría permanecer una población bacteriana en la pelvis y parénquima renal después de una IH febril. Este hecho insólito y no mencionado en la actualidad, podría explicar la recurrencia de algunos de casos de IU. En los años 60 del pasado siglo se enfatizó la relación entre pielonefritis crónica y RVU2,8.
Nefropatía de reflujo. El RVU no es la causa de las infecciones urinarias. Varios autores
Hace años, la IU se ha asoció con deterioro de la función renal, insuficiencia renal terminal y muerte9, de tal modo que se comunicó que el RVU era la causa de insuficiencia renal terminal en el 20 a 30% de niños y adolescentes10. En la actualidad, esa frecuencia se ha reducido notablemente debido, principalmente, a la posibilidad de un diagnóstico más precoz y de un tratamiento más temprano de las pielonefritis agudas cuando se asocian a esa malformación.
La idea de que el RVU predispone o es la causa de las infecciones urinarias, está muy extendida en la comunidad médica. Muchos niños con RVU se intervienen quirúrgicamente “para intentar evitar que padezcan nuevas IU”. Este concepto se basa en que la mayoría de las IU son ascendentes. Las bacterias que alcanzan la vejiga desde la uretra, no son evacuadas completamente después de cada micción puesto que, en presencia de RVU, se reintegran, de nuevo, a la vejiga. No obstante, ese concepto no explica el motivo por rl que las bacterias irrumpen inicialmente en la vejiga. Se ha publicado que la frecuencia de IU desciende después de la corrección quirúrgica del reflujo11. Esto, sin embargo, no demuestra inequívocamente los efectos beneficiosos de la cirugía, puesto que la incidencia de IU también se reduce con el paso del tiempo, también, en los niños no intervenidos12. Govan y Palmer revisaron la incidencia de IU en dos grupos de pacientes, el primero integrado por niños con RVU corregido quirúrgicamente y el segundo por pacientes sin RVU. Pues bien, la incidencia de IU recurrentes fue similar en ambos grupos13.
En los tiempos en que no se efectuaba la profilaxis antibiótica, Kunin et al. estudiaron un grupo de pacientes entre 5 y 19 años afectos de IU recidivantes, con o sin RVU. La recurrencia de infección urinaria fue más alta, incluso, en los niños sin RVU14.
El concepto de que el RVU no es, en sí mismo, la causa de las IU se apoya en otras dos observaciones. En primer lugar, el hecho de que el 75% de los hermanos de pacientes con RVU son portadores de esta malformación y no padecen IU. En segundo lugar, la observación repetida de que mujeres que en la infancia fueron diagnosticadas de RVU, en los embarazos tienen una mayor incidencia de IU en relación con un grupo control15.
Basados en estas observaciones, en la actualidad se cree que el RVU no es la causa final de las IU y que tanto los pacientes con RVU como aquellos que sufren IU recurrentes, están predispuestos genéticamente a padecer éstas infecciones.
El termino nefropatía de reflujo a pesar de su amplia aceptación, incluso en la actualidad, es ciertamente, controvertido. En primer lugar, se sabe que algunos niños con VUR nacen con lesiones en las que existe pérdida de parénquima congénita (displasia renal, hipodisplasia) que no son causadas necesariamente por VUR sino otra malformación asociada al mismo y que, obviamente, no son cicatrices sensu stricto (congenital reflux nephropathy). En segundo lugar, como se mencionará a continuación, para formarse cicatrices renales residuales después de una IU febril no es necesario ser portador de VUR. Las cicatrices son secundarias a la inflamación ubicada en el parénquima renal que se desencadena por la irrupción de bacterias patógenas.
Shapiro et al., 1959. La cicatriz es una consecuencia de la inflamación bacteriana7,16. Las cicatrices no son causadas por el RVU
Los artículos de Shapiro et al. publicados a finales de la década de los años 50 del pasado siglo demostraron de forma clara que la pielonefritis experimental inducida en ratas causaba una inflamación que devenía en fibrosis y perdida de zonas de parénquima renal (figuras 1 y 2)7,16. Esos autores inocularon por vía intracardiaca cepas de escherichia coli, proteus morganii y streptococcus zymogenes, es decir, en ausencia de RVU. Sorprendentemente, observaron que las lesiones residuales renales eran diferentes según el tipo de bacteria inoculada. Así, observaron que la infección causada por escherichia coli era autolimitada pero con lesiones residuales crónicas. Por otra parte, proteus morganii producía una marcada destrucción renal, formación de cálculos e hidronefrosis. El comportamiento virulento distinto de los tres tipos bacterianos puede explicarse por poseer propiedades antigénicas distintas, es decir, con una capacidad diferente para adherirse a los receptores de las fimbrias existentes en el urotelio y el tejido renal.
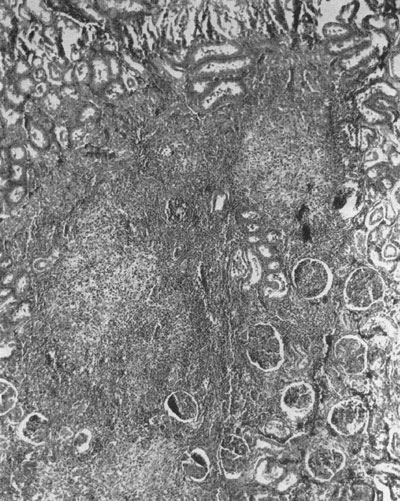
Figura 1. Riñón pielonefrítico seis semanas después de una infección producida por Proteus. Se observa fibrosis y amontonamiento de glomérulos
(X70)7

Figura 2. Riñon pielonefrítico seis semanas después de una infección producida por Proteus. Se observa fibrosis (X16) en un tono pálido en las áreas lesionales (light blue in Mallory Stain)7
A partir de esos estudios pioneros y posteriores, se considera que una cicatriz expresa la pérdida de tejido cortical renal que se produce en el contexto del conflicto que se establece en la corteza renal entre las bacterias y el sistema inmunitario del huésped, independientemente de la existencia o no de hiperpresión en la vía urinaria o RVU17,18.
En relación con los factores de virulencia bacteriana, la gravedad de la inflamación es el factor más importante que interviene en el futuro del parénquima renal19. La inflamación es un arma de doble filo ya que es necesaria para eliminar las bacterias, pero si es excesiva, se produce la lesión renal, en la que las nefronas se destruyen y se reemplazan con depósitos de matriz extracelular20. Leucocitos, células dendríticas, macrófagos y otras células productoras de catelicidinas se desplazan al área parenquimatosa afectada durante la pielonefritis21. Las células inflamatorias, en particular, los granulocitos, debido a las enzimas que contienen17, junto a las toxinas bacterianas liberadas, causan las lesiones parenquimatosas mediante obstrucción capilar e hipoxia. La fagocitosis propia de los macrófagos conduce a la liberación de citocinas, ácido araquidónico, radicales de oxígeno y enzimas lisosomales. Este proceso es destinado a destruir las bacterias, pero también provoca lesiones en los tejidos22. Los macrófagos inducen fibrosis a través de proliferación y activación de fibroblastos23. Éstos, juegan un papel importante en la reparación de tejidos después de una lesión.
En definitiva, el requisito para desarrollar una cicatriz renal después de una infección, es la infección en sí misma, más que la presencia o ausencia de RVU24. Esa es la razón por la que el término “nefropatía de reflujo” es obsoleto y se ha sugerido sustituirlo por el de “nefropatía cicatrizal”.
Formación de cicatrices. ¿Si la presencia de reflujo no es necesaria para la aparición de nefropatía cicatrizal, porqué ésta se relaciona con la intensidad del reflujo?
Se han realizado muchos estudios destinados a conocer cuales son los factores de riesgo que favorecen la formación de cicatrices. La información existente fue resumida espléndidamente en la “Guía de Practica Clínica sobre Infección del Tracto Urinario en la Población Pediatrica”25 de la que resumimos, a continuación, los aspectos que consideramos más importantes.
Se ha descrito que la existencia de IU de repetición incrementa el riesgo de tener un daño renal permanente26.
Aunque se había comunicado lo contrario, no se ha podido demostrar la asociación entre retraso en el inicio del tratamiento antibiótico y un mayor riesgo de daño renal permanente27. Esto confirma que la formación de una cicatriz, aparte de factores genéticos intrínsecos del huésped que comentaremos más adelante, depende en gran medida de la virulencia bacteriana.
En los años 80 del pasado siglo, se afirmó que la capacidad de formar cicatrices era más propia en la época de lactante y que pasados los cinco años de edad era muy difícil su presencia28,29. En los últimos años han aparecido algunos artículos que indican lo contrario, es decir, que el riesgo es mayor a medida que se incrementa la edad del paciente30. Este hecho de difícil explicación no se ha observado en otros estudios realizados en los últimos años31,32.
Cuando las IU se producen por bacterias distintas de Escherichia coli, también, se ha observado un mayor riesgo de formación de cicatrices7,16,33. Una vez más, es notable el efecto de la virulencia bacteriana cuyos efectos ya se conocían desde los estudios de Shapiro et al., antes mencionados7,16.
En bastantes estudios, se ha descrito un mayor riesgo de cicatrización renal que es especialmente marcado en los casos de RVU que cursan con dilatación de la vía urinaria34,35. Scherlz el al. demostraron tres meses después de un proceso infeccioso renal agudo, una incidencia de un 9% de cicatrices en pacientes con RVU grados I y II y, en cambio, de un 42% en aquellos con RVU grados III-V36.
¿Entonces, si las cicatrices son el resultado final de un fenómeno inflamatorio en el que no es necesaria la presencia de RVU, cual es la razón de que la intensidad del RVU se asocie con un mayor riesgo de cicatrices? Ciertamente, no se sabe, pero la causa parece estar en relación con que los casos de RVU graves se asocian con pielonefritis causadas por bacterias más virulentas37,38. En este sentido, Marcus et al. mostraron que en los casos de anomalías urológicas y RVU, las IU causadas por enterococos y pseudomonas eran más frecuentes en comparación con las originadas por E. coli, respectivamente39,40.
Nefropatía congénita asociada a reflujo vesicoureteral
Como hemos comentado más arriba, algunos niños con RVU nacen con lesiones congénitas en las que existe pérdida del parénquima renal, especialmente displasia renal41 o riñones de pequeño tamaño42. Habitualmente, la displasia renal se asocia con RVU masivo, es en general unilateral y, se observa, especialmente, en varones43. En estos casos, en la gammagrafia o en el renograma, la captación isotópica es nula. En definitiva, asociadas al RVU/IU pueden existir dos tipas de lesiones morfológicas, unas congénitas y, las otras, adquiridas (cicatrices)44. Es por ello, por lo que, en realidad, la nefropatía cicatrizal debería denominarse “nefropatía displasico-cicatrizal”.
La nefropatía de reflujo y la nefropatía displásico-cicatrizal como entidades diferentes evidenciables por el estudio de las pruebas de función renal básicas
Aunque sea complejo, se pueden distinguir, desde el punto de vista funcional las dos circunstancias. En primer lugar, la nefropatía de reflujo seria la lesión funcional renal asociada a la hiperpresión en la vía urinaria causada por el propio RVU junto a la originada por la pérdida de parénquima existente en el momento del diagnostico. En este caso, en relación con la función renal, se ha comprobado que existe defecto de la capacidad de concentración en el 69,5% de los casos45,46, que alcanza el 100% en los casos de RVU de grados IV y V47. Además, se comprueba elevación de la albuminuria en un porcentaje bajo de casos (19,6%)48,49 y un incremento de la eliminación urinaria de NAG (N-acetilglucosaminidasa) (37%), un marcador de lesión tubular proximal renal47,50-52.
Una vez curado el RVU de forma espontanea o mediante tratamiento quirúrgico, la lesión funcional es, únicamente, la que corresponde a la pérdida de parénquima. Es lo que correspondería a la nefropatía displásico-cicatrizal. En este caso, el deterioro funcional es el que corresponde a la restricción nefronal independientemente del grado de RVU inicial. Así, el defecto de la capacidad de concentración se reduce a 19,5%53. Por el contario, la albuminuria se mantiene en un porcentaje similar al del inicio (17,6%), lo que parece estar en relación con la hiperfiltración asociada a la perdida de parenquima54. Con respecto a la eliminación urinaria de NAG se normaliza, lo que indica que es una marcador de hiperpresión en la vía urinaria, aunque menos sensible que la osmolalidad urinaria máxima55.
Bases genéticas que favorecen la formación de cicatrices
Como se recordó en el primer capítulo de esta serie1, los ratones con defectos en el receptor de IL-8, mIL-8Rh (homologo de CXCR1 y CXCR2 en humanos) son más susceptibles a padecer IU y tienen más riesgo de formar cicatrices renales56,57. En este sentido, en niños propensos a padecer pielonefritis agudas, se ha descrito una expresión reducida, con respecto a los controles, del receptor de la citocina IL-8 58,59. El factor de crecimiento transformante-beta 1 (TGF-beta1) es una proteína pro-fibrotica. Pues bien, algunos polimorfismos de la misma se han asociado con la formación de cicatrices renales60.
Pasando a otro aspecto del tema, la prelitiasis es aquella situación en la que se detecta que un sujeto, generalmente inscrito en la edad pediátrica, es portador de anomalías metabólicas causantes de cálculos61, especialmente hipercalciuria e hipocitraturia. Una de las manifestaciones clínicas más tempranas de prelitiasis en niños es en forma de IU.
En 1987, Cervera et al. comunicaron que la frecuencia de IU en pacientes con hipercalciuria idiopática era del 48,9%62. Esta asociación se confirmó en varias series posteriores63-65, en contraposición con la frecuencia de IU en la población de control sin hipercalciuria, en la que la prevalencia estimada se sitúa entre el 1 y el 2% de los niños y el 3,5% de las niñas66. De manera similar e inversa, la prevalencia de hipercalciuria reportada en series pediátricas de IU oscila entre el 2067 y el 44%68. En un estudio reciente, observamos una asociación entre prelitiasis y la existencia de cicatrices renales en niños con IU por E.coli69. Este hecho no se había descrito con anterioridad en la literatura sobre el tema. Es probable, pues, que los niños con prelitiasis tengan una capacidad de defensa reducida contra esas bacterias y, en consecuencia, un mayor riesgo de desarrollar cicatrices renales.
Medulonefritis
Aunque no está indicada su realización de modo habitual, la gammagrafía renal (DMSA) realizada en fase aguda es la prueba de oro para el diagnóstico de la pielonefritis aguda. Desde hace años se sabe que en algunos pacientes con sospecha de pielonefritis aguda por tener clínica y marcadores bioquímicos positivos, la gammagrafía puede ser normal. Estos falsos negativos son más frecuentes en lactantes con menos de dos años de edad.

Figura 3. Riñón infectado por streptococcus zymogenes (X15). Se observa un marcado engrosamiento pélvico, dilatación de los túbulos colectores y lesiones infiltrativas en la médula, mientras que la corteza está bastante libre de daño16.
En 2014 publicamos un artículo en el que incluimos 85 lactantes menores de un año de edad que habían sido ingresados en el hospital por una probable pielonefritis aguda. Todos los pacientes tenían clínica compatible, una PCR elevada y fiebre ≥38 ºC. En 64 de ellos (75,3%) el DMSA fue patológico y en los 21 restantes, normal. No hubo diferencias en las variables clínicas y analíticas recolectadas en ambos grupos, excepto en los niveles de proteína C reactiva. Lo sorprendente es que en ambos grupos, la mayoría de los niños exhibieron una osmolalidad urinaria máxima reducida (87,5% en el primer grupo y 85,7% en el segundo). El 33,9% de los pacientes con un DMSA anormal mostró cicatrices renales después de 6-12 meses. Ningún paciente con DMSA normal mostró cicatrices. Desde hace años se sabe que la capacidad de concentración renal se deteriora de forma transitoria en las pielonefritis agudas. La concentración renal es un proceso en el que intervienen varios segmentos tubulares pero, especialmente, es un mecanismo propio de la médula renal. Nuestra hipótesis es que en los casos con clínica y analítica característica de pielonefritis aguda pero con osmolalidad urinaria máxima reducida y DMSA normal, la infección podría estar localizada en la médula renal (medulonefritis). Otra opción es que se tratase de una exploración falsamente negativa por tratarse de pacientes de corta edad70.
La opción anatomopatológica de que exista afectación solo de la medula renal en una pielonefritis aguda fue demostrada por Shapiro et al. en un artículo antes mencionado16. En un riñón infectado por streptococcus zymogenes se observaron lesiones infiltrativas en la médula, mientras que la corteza está bastante libre de daño (figura 3).
En un modelo experimental se ha comunicado que las células del túbulo colector medular son el sitio principal de adhesión bacteriana, en las que se inicia la respuesta inflamatoria estimulada por bacterias escherichia coli uropatógenas71. Chassin et al. demostraron que esas bacterias cuando invaden los riñones se unen específicamente a la superficie apical de las células del ducto colector, principalmente a las células intercaladas con lo que son reconocidas y se inicia una respuesta inmune utilizando varias vías de señalización distintas72.
Es bien sabido que el riñón sintetiza constitutivamente un número de péptidos antimicrobianos con amplia especificidad como RNAsa7 73,74 y catelicidina75,76, pero se sabe menos sobre el respuestas agudas de los riñones en el caso de las IU. Se ha descrito que la proteína bacteriostática lipocalina 2 (LCN2; también conocida como NGAL) se secreta en respuesta a IU causadas por bacterias Gram negativas tanto en cohortes humanas como en animales de experimentación77. LCN2 se expresa por las células ubicadas en segmentos distales de la nefrona. Las células α-intercaladas del ducto colector renal son fundamentales en la homeostasis ácido-base pero, también, sirven como “centinelas” y efectores en la defensa contra las IU. En un modelo de infección del tracto urinario murino, las células α-intercaladas del ducto colector renal se unieron a E. coli uropatógeno. Las células respondieron acidificando la orina y secretando la proteína bacteriostática lipocalina 2 (figura 4). La presencia de LCN2 en la orina fue necesaria y suficiente para controlar la IU a través del secuestro férrico, incluso en condiciones menos favorables con la orina acidificada. En ratones que carecen de células α-intercaladas, tanto la LCN2 urinaria como la acidificación urinaria se reducen y, por ello, el aclaramiento bacteriano se limita78,79.
En consecuencia, con los datos aportados más arriba y, según nuestra hipótesis, si la infección se detiene cuando las bacterias aparecen en el ducto colector medular, su progresión hacia la corteza renal podría ser impedida y localizarse únicamente en la médula renal.

Figura 4. Modelo experimental de un ratón portador de la proteína LCN2 fluorescente (LCN2- Luc2-mCherry)78,79. Basada en una figura publicada en la referencia 79: en los tractos urogenitales extirpados el día 1 día después de la inoculación se verificó que la luminiscencia de LCN2 se originó en la médula renal (en color verde)
Bibliografía
- García Nieto VM, González Díaz I, Moraleda Mesa T, Tejera Carreño P, Luis Yanes MI. Los artículos clave en la historia del conocimiento de las infecciones en el ser humano. I. Las bacterias. Can Pediatr 2019; 43:226-233
- Hodson CJ, Edwards D. Chronic pyelonephritis and vesico-ureteric reflux. Clin Radiol 1969; 11:219-231
- Stansfeld JM, Webb JK. A plea for the longer treatment of chronic pyelonephritis in children. Br Med J 1954; 1:616-618
- Sommers SC, Gonick HC, Kalmanson GM, Guze LB. Pathogenesis of chronic pyelonephritis. II. Effect of repetitive infection. Am J Pathol 1964; 45:729-739
- Brainerd HD, Cecil LM. Observations on the pathogenesis, course and treatment of nonobstructive pyelonephritis. Ann Intern Med 1956; 45:232-241
- Kleeman CR, Epstein FH. An illustrative case of chronic pyelonephritis with persistently hypotonic urine. Am J Med 1957; 23:488-492
- Braude AI, Shapiro AP, Siemienski J. Hematogenous pyelonephritis in rats. III. Relationship of bacterial species to the pathogenesis of acute pyeionephritis. J Bacteriol 1959; 77:270-280
- Bailey RR. The relationship of vesico-ureteric reflux to urinary tract infection and chronic pyelonephritis-reflux nephropathy. Clin Nephrol 1973; 1:132-141
- Steele RE, Leadbetter GW, Crawford JD. Prognosis of childhood urinary-tract infection. The current status of patients hospitalised between 1940 and 1950. N Engl J Med 1963; 269:883-889
- Broyer M, Donckerwolcke RA, Brunner FP, Brynger H, Jacobs C, Kramer P et al. Combined report on regular dialysis and transplantation of children in Europe, 1980. Proc Eur Dial Transplant Assoc 1981; 18:60-87
- Willscher MK, Bauer SB, Zammuto PJ, Retik AB. Infection of the urinary tract after anti-reflux surgery. J Pediatr 1976; 89:743-746
- Elo J, Tallgreen LG, Sarna S, Alfthan O, Stenstrom R. The role of vesicoureteral reflux in pediatric urinary-tract infection. Scand J Urol Nephrol 1981; 15:243-248
- Govan DE, Palmer JM. Urinary tract infection in children. The influence of successful antireflux operation in morbidity from infection. Pediatrics 1969; 44:677-684
- Kunin CM, Deutscher R, Paquin A Jr. Urinary tract infection in school children: an epidemiological, clinical, and laboratory study. Medicine (Baltimore) 1964; 43:91-130
- Mansfield JT, Snow BW, Cartwright PC, Wadsworth K. Complications of pregnancy in women after childhood reimplantation for vesicoureteral reflux: an update with 25 years of follow-up. J Urol 1995; 154:787-790
- Shapiro AP, Braude AI, Siemienski J. Hematogenous pyelonephritis in rats. IV. Relationship of bacterial species to the pathogenesis and sequelae of chronic pyelonephritis. J Clin Invest 1959; 38:1228-1240
- Ragnarsdóttir B, Svanborg C. Susceptibility to acute pyelonephritis or asymptomatic bacteriuria: host-pathogen interaction in urinary tract infections. Pediatr Nephrol 2012; 27:2017-2029
- Garin EH, Campos A, Homsy Y. Primary vesicoureteral reflux: review of current Pediatr Nephrol 1998; 12:249-256
- Liu Y. Cellular and molecular mechanisms of renal fibrosis. Nat Rev Nephrol 2011; 7:684-696
- Murugapoopathy V, McCusker C, Gupta IR. The pathogenesis and management of renal scarring in children with vesicoureteric reflux and pyelonephritis. Pediatr Nephrol 2020; 35:349-357.
- Duann P, Lianos EA, Ma J, Lin PH. Autophagy, innate immunity and tissue repair in acute kidney injury. Int J Mol Sci 2016; 17:pii: E662
- Sharifian M, Anvaripour N, Karimi A, Fahimzad A, Mohkam M, Dalirani R et al. The role of dexamethasone on decreasing urinary cytokines in children with acute pyelonephritis. Pediatr Nephrol 2008; 23:1511-1516
- Zec K, Volke J, Vijitha N, Thiebes S, Gunzer M, Kurts C et al. Neutrophil migration into the infected uroepithelium is regulated by the crosstalk between resident and helper macrophages. Pathogens 2016; 5:pii: E15
- Rushton HG. The evaluation of acute pyelonephritis and renal scarring with technetium 99m-dimercaptosuccinic acid renal scintigraphy: evolving concepts and future directions. Pediatr Nephrol 1997; 11:108-120.
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infeccion del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Instituto Aragonés de Ciencias de la Salud; 2011. Guías de Práctica Clínica en el SNS: I+CS No 2009/01
- Orellana P, Baquedano P, Rangarajan V, Zhao JH, Eng ND, Fettich J et al. Relationship between acute pyelonephritis, renal scarring, and vesicoureteral reflux. Results of a coordinated research project. Pediatr Nephrol 2004; 19:1122-1126
- Hewitt IK, Zucchetta P, Rigon L, Maschio F, Molinari PP, Tomasi L et al. Early treatment of acute pyelonephritis in children fails to reduce renal scarring: data from the Italian Renal Infection Study Trials. Pediatrics 2008; 122:486-490
- Claësson I, Jacobsson B, Jodal U, Winberg J. Compensatory kidney growth in children with urinary tract infection and unilateral renal scarring: an epidemiologic study. Kidney Int 1981; 20:759-764
- Sterner G, Christensson A, Jonsson K. Clinical and radiological follow-up of chronic non-obstructive pyelonephritis. A retrospective study covering thirty years. Scand J Urol Nephrol 1988; 22:299-303
- Soylu A, Demir BK, Turkmen M, Bekem O, Saygi M, Cakmakci H et al. Predictors of renal scar in children with urinary infection and vesicoureteral reflux. Pediatr Nephrol 2008; 23:2227-2232
- Bouissou F, Munzer C, Decramer S, Roussel B, Novo R, Morin D et al. Prospective, randomized trial comparing short and long intravenous antibiotic treatment of acute pyelonephritis in children: dimercaptosuccinic acid scintigraphic evaluation at 9 months. Pediatrics 2008; 121:e553-e560
- Coulthard MG, Lambert HJ, Keir MJ. Do systemic symptoms predict the risk of kidney scarring after urinary tract infection? Arch Dis Child 2009; 94:278-281
- Shaikh N, Craig JC, Rovers MM, Da Dalt L, Gardikis S, Hoberman A et al. Identification of children and adolescents at risk for renal scarring after a first urinary tract infection: a meta-analysis with individual patient data. JAMA Pediatr 2014; 168:893-900
- Swerkersson S, Jodal U, Sixt R, Stokland E, Hansson S. Relationship among vesicoureteral reflux, urinary tract infection and renal damage in children. J Urol 2007; 178:647-651
- Shaikh N, Ewing AL, Bhatnagar S, Hoberman A. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics 2010; 126:1084-1091
- Scherlz HC, Downs TM, Caesar R. The selective use of dimercaptosuccinic acid renal scan in children with vesicoureteral reflux. J Urol 1994; 152: 628-631
- de Man P, Cläeson I, Johanson IM, Jodal U, Svanborg Edén C. Bacterial attachment as a predictor of renal abnormalities in boys with urinary tract infection. J Pediatr 1989; 115:915-922
- Hogan J, Mahjoub F, Larakeb AS, Vu Thien H, Hosany A, Bensman A et al. Escherichia coli virulence patterns may help to predict vesicoureteral reflux in paediatric urinary tract infections. Acta Paediatr 2015; 104:e460-465
- Marcus N, Ashkenazi S, Samra Z, Cohen A, Livni G. Community-acquired enterococcal urinary tract infections in hospitalized children. Pediatr Nephrol 2012; 27: 109-114
- Marcus N, Ashkenazi S, Samra Z, Cohen A, Livni G. Community-acquired Pseudomonas aeruginosa urinary tract infections in children hospitalized in a tertiary center: relative frequency, risk factors, antimicrobial resistance and treatment. Infection 2008; 36: 421-426
- Yeung CK, Godley ML, Dhillon HK, Gordon I, Duffy PG, Ransley PG. The characteristics of primary vesico-ureteric reflux in male and female infants with pre-natal hydronephrosis. J Urol 1997; 80:319-327
- Hiraoka M, Hori C, Tsukahara H, Kasuga K, Ishihara Y, Sudo M. Congenitally small kidneys with reflux as a common cause of nephropathy in boys. Kidney Int 1997; 52:811-816
- Scott JE. Fetal ureteric reflux. Br J Urol 1987; 59:291-296
- Peters C, Rushton HG. Vesicoureteral reflux associated renal damage: congenital reflux nephropathy and acquired renal scarring. J Urol 2010; 184:265-273
- Monge M, Abreu-Yanes I, García-Rodríguez V, González-Cerrato S, Luis-Yanes MI, Claverie-Martin F, et al. Differences in renal function in 3 morphological anomalies that occur with severe dilation on the urinary tract in children. Pediatr Nephrol 2011; 26:1700
- García Nieto V, González Cerrato S, García Rodríguez VE, Mesa Medina O, Hernández González MJ, Monge Zamorano M et al. ¿Debe realizarse una cistografía a todos los lactantes con dilatación leve y moderada de las vías urinarias? Las pruebas de función renal pueden ayudar a responder esta pregunta. Nefrología 2011;31:192-198
- García-Nieto V, García-Rodríguez VE, Luis-Yanes MI, Monge M, Arango-Sancho P, Garin EH. Renal tubular markers as screening tools for severe vesicoureteral reflux. Eur J Pediatr 2019; 178:525-531
- Tomlinson PA, Smellie JM, Prescod N, Dalton RN, Chantler C. Differential excretion of urinary proteins in children with vesicoureteric reflux and reflux nephropathy. Pediatr Nephrol 1994; 8:21-25
- Konda R, Kakizaki H, Nakai H, Hayashi Y, Hosokawa S, Kawaguchi S et al. Reflux Nephrology Forum, Japanese Prospective Study Group. Urinary concentrations of alpha-1-microglobulin and albumin in patients with reflux nephropathy before and after puberty. Nephron 2002; 92:812-816
- Carr MC, Peters CA, Retik AB, Mandell J. Urinary levels of renal tubular enzyme N-acetyl-D-glucosaminidase in relation to grade of vesicoureteral reflux. J Urol 1991; 146:654-656
- Williams MA, Jones D, Noe NH. Urinary N-acetyl-beta-glucosaminidase as a screening technique for vesicoureteral reflux. Urology 1994; 43:528-530
- Miyakita H, Puri P. Urinary levels of N-acetyl-beta-D-glucosaminidase: A simple marker for predicting tubular damage in higher grades of vesicoureteric reflux. Eur Urol 1994; 25:135-137
- Ibáñez Alonso A, Luis Yanes MI, Carmona Cedrés N, Antón Hernández L, García Nieto V. Determinación de la función renal al final del periodo de seguimiento en niños diagnosticados de reflujo vesicoureteral. Arch Esp Urol 2008; 61:167-172
- Luis-Yanes MI, Martín-Conde L, Hernández-Sanjuán MI, Alberto-Alonso JR, Hernández-González MJ, Antón L et al. Albumin urinary excretion is preferently a hyperfiltration marker in children with vesicoureteral reflux. Pediatr Nephrol 2011; 26:1700
- Hernández-González MJ, González-Cerrato S, Álvarez-Martín N, Monge M, Luis-Yanes MI, Antón L et al. N-acetilglucosaminidase is a marker of high pressure at the urinary tract in vesicoureteral reflux. Pediatr Nephrol 2011; 26:1700-1701
- Godaly G, Hang L, Karpman D, Lundstedt AC, Svanborg C. Interleukin 8 receptor deficiency confers susceptibility to acute experimental pyelonephritis and may have a human counterpart. J Exp Med 2000; 192:881-890
- Svensson M, Irjala H, Alm P, Holmqvist B, Lundstedt AC, Svanborg C. Natural history of renal scarring in susceptible mIL-8Rh-/- mice. Kidney Int 2005; 67:103-110
- Lundstedt AC, Leijonhufvud I, Ragnarsdottir B, Karpman D, Andersson B, Svanborg C. Inherited susceptibility to acute pyelonephritis: a family study of urinary tract infection. J Infect Dis 2007; 195:1227-1234
- Artifoni L, Negrisolo S, Montini G, Zucchetta P, Molinari PP, Cassar W et al. Interleukin-8 and CXCR1 receptor functional polymorphisms and susceptibility to acute pyelonephritis. J Urol 2007; 177:1102-1106
- Cotton SA, Gbadegesin RA, Williams S, Brenchley PE, Webb NJ. Role of TGF-beta1 in renal parenchymal scarring following childhood urinary tract infection. Kidney Int 2002; 61:61-67
- Jung A, Kamińska A, Olszewski S, Rutka J. A form of premorbid condition of urolithiasis and urinary stone composition in children with urolithiasis. Pol Merkur Lekarski 2000; 8:188-190
- Cervera A, Corral MJ, Gómez Campdera FJ, de Lecea AM, Luque A, López Gómez JM. Idiopathic hypercalciuria in children. Classification, clinical manifestations and outcome. Acta Paediatr Scand 1987;76:271-278
- Vachvanichsanong P, Malagon M, Moore ES. Urinary tract infection in children associated with idiopathic hipercalciuria. Scand J Urol Nephrol 2001; 35:112-116
- Heiliczcer J, Canonigo BB, Bishof NA, Moore ES. Non calculi urinary tract disorders secondary to idiopathic hypercalciuria in children. Pediatr Clin North Am 1987; 34:711-718
- Escribano J, Balaguer A, Martin R, Feliu A, Espax R. Childhood idiopathic hypercalciuria. Scand J Urol Nephrol 2003; 38:422-426
- Jodal U, Winberg J. Management of children with unobstructed urinary tract infection. Pediatr Nephrol 1987; 1:647-656
- Balestracci A, Battaglia LM, Toledo I, Martin SM, Wainsztein RE. Hipercalciuria idiopática en niños con infección del tracto urinario. Arch Argent Pediatr 2014; 112:428-433
- Stojanović VD, Milosević BO, Djapić MB, Bubalo JD. Idiopathic hypercalciuria associated with urinary tract infection in children. Pediatr Nephrol 2007; 22:1291-1295
- García Nieto V, Sotoca Fernández J, O’Hagan M, Arango Sancho P, Luis Yanes MI. A family history of renal lithiasis in children diagnosed of urinary tract infection by Escherichia coli. An Pediatr (Barc) 2018; 88:204-208
- García-Nieto V, González-Cerrato S, Luis-Yanes MI, Monge-Zamorano M,Reyes-Millán B. Decreased concentrating capacity in children with febrile urinary tract infection and normal 99mTc-dimercaptosuccinic acid scan: does medullonephritis exist? World J Pediatr 2014; 10:133-137
- Chassin C, Tourneur E, Bens M, Vandewalle A. A role for collecting duct epithelial cells in renal antibacterial defences. Cell Microbiol 2011; 13:1107-1113
- Chassin C, Goujon JM, Darche S, du Merle L, Bens M, Cluzeaud F et al. Renal collecting duct epithelial cells react to pyelonephritis-associated Escherichia coli by activating distinct TLR4-dependent and -independent inflammatory pathways. J Immunol 2006; 177:4773-4784
- Spencer JD, Schwaderer AL, Dirosario JD, McHugh KM, McGillivary G, Justice SS et al. Ribonuclease 7 is a potent antimicrobial peptide within the human urinary tract. Kidney Int 2011; 80:174-180
- Eichler T, Bender K, Murtha MJ, Schwartz L, Metheny J, Solden L et al. Ribonuclease 7 shields the kidney and bladder from invasive uropathogenic escherichia coli infection. J Am Soc Nephrol 2019; 30:1385-1397
- Chromek M, Slamová Z, Bergman P, Kovács L, Podracká L, Ehrén I et al. The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection. Nat Med 2006; 12:636-641
- Chromek M. The role of the antimicrobial peptide cathelicidin in renal diseases. Pediatr Nephrol 2015; 30:1225-1232
- Mori K, Lee HT, Rapoport D, Drexler IR, Foster K, Yang J et al. Endocytic delivery of lipocalin siderophore-iron complex rescues the kidney from ischemia-reperfusion injury. J Clin Invest 2005; 115:610-621
- Paragas N, Qiu A, Zhang Q, Samstein B, Deng SX, Schmidt-Ott KM et al. The Ngal reporter mouse detects the response of the kidney to injury in real time. Nat Med 2011; 17:216–222
- Paragas N, Kulkarni R, Werth M, Schmidt-Ott KM, Forster C, Deng R et al. α-Intercalated cells defend the urinary system from bacterial infection. J Clin Invest 2014; 124:2963-2976

